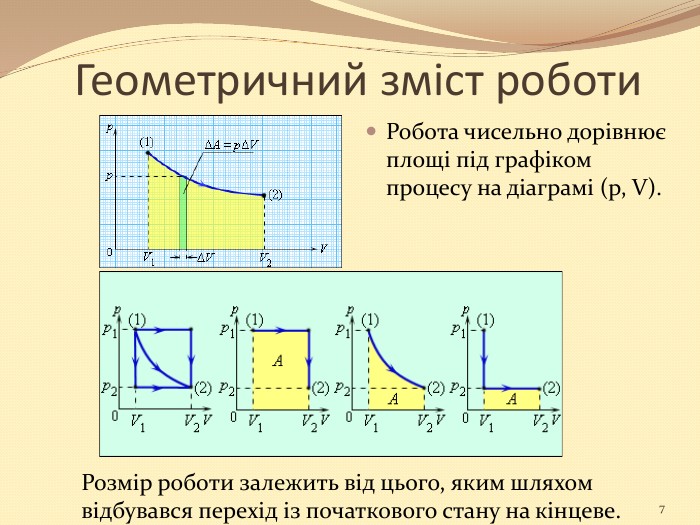
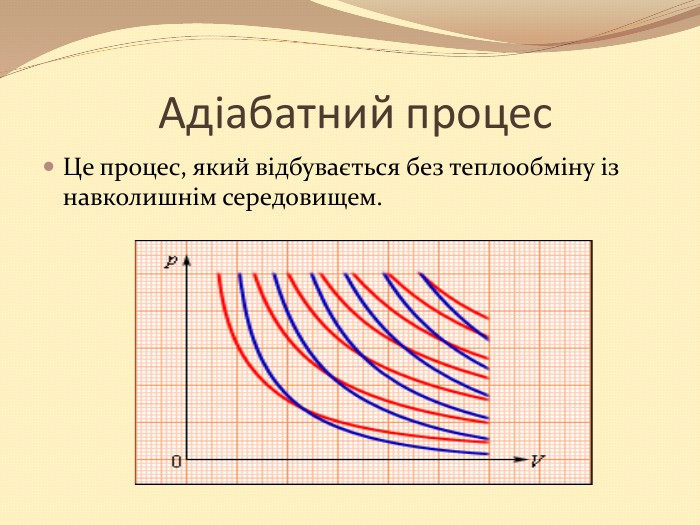
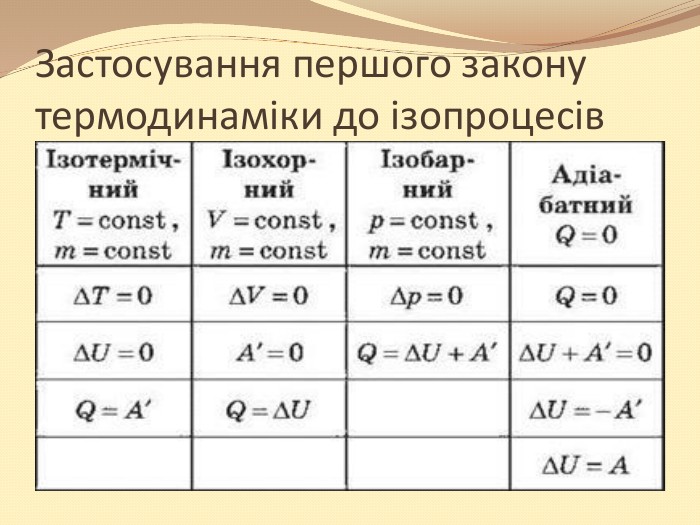
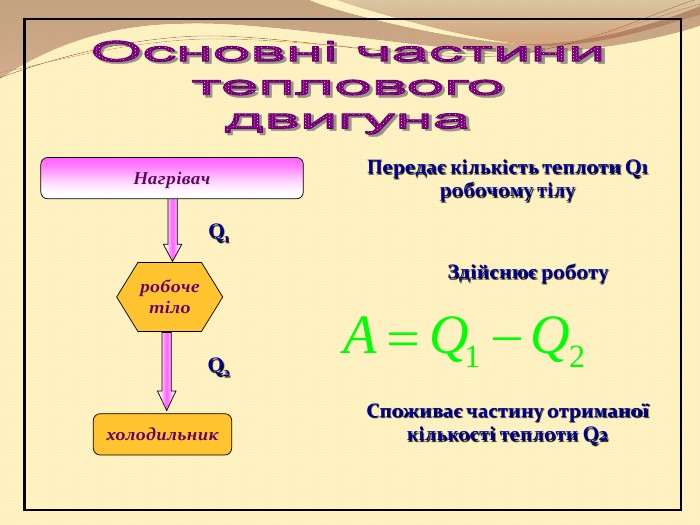
Презентація "10 клас Основи термодинаміки"
Про матеріал
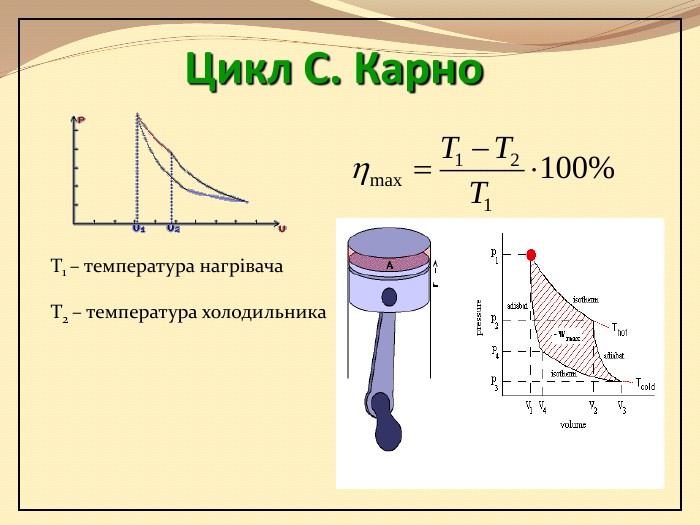
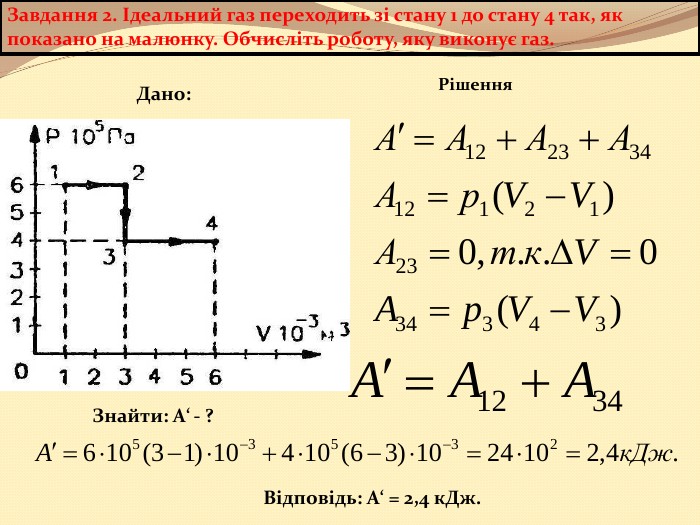
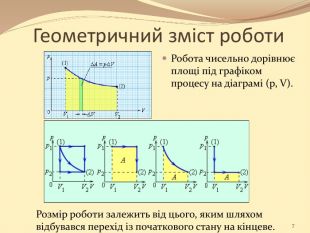
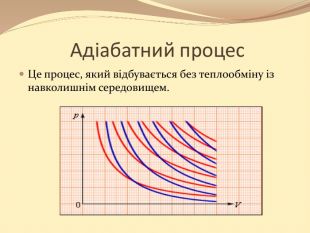
Презентація містить матеріал розробки уроку за темою "Основи термодинаміка"
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку