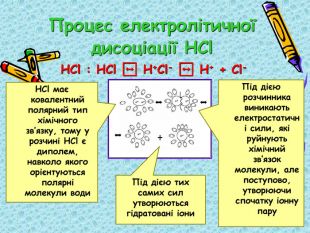
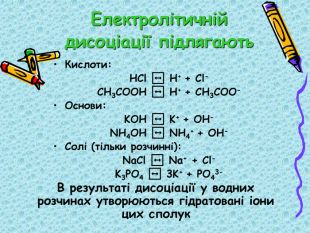
Презентація "9кл. Електролітична дисоціація"
Про матеріал
Конспект уроку у вигляді презентації. Можно використовувати на уроках для дітей з ООП - підвищення наочності навчального матеріалу, підтримка звукового сприйняття додатковою візуалізацією. Перегляд файлу
Зміст слайдів
ppt
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку