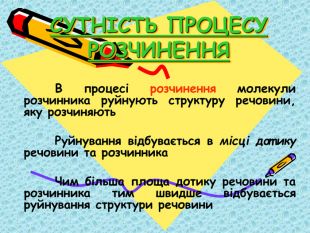
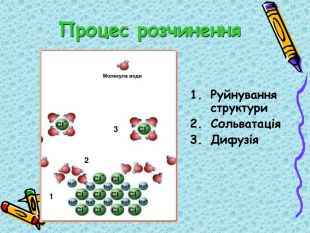
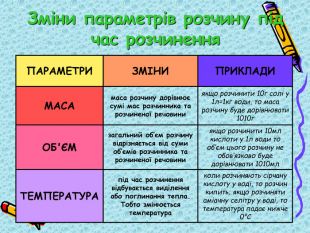
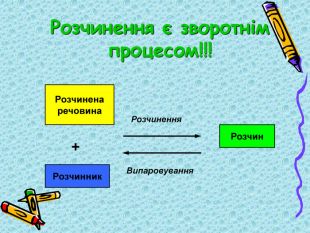
Презентація "9кл. Сутність процесу розчинення"
Про матеріал
Конспект уроку у вигляді презентації. Можно використовувати на уроках для дітей з ООП - підвищення наочності навчального матеріалу, підтримка звукового сприйняття додатковою візуалізацією. Перегляд файлу
Зміст слайдів
ppt
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку