Презентація "Амфотерні гідроксиди"
Про матеріал
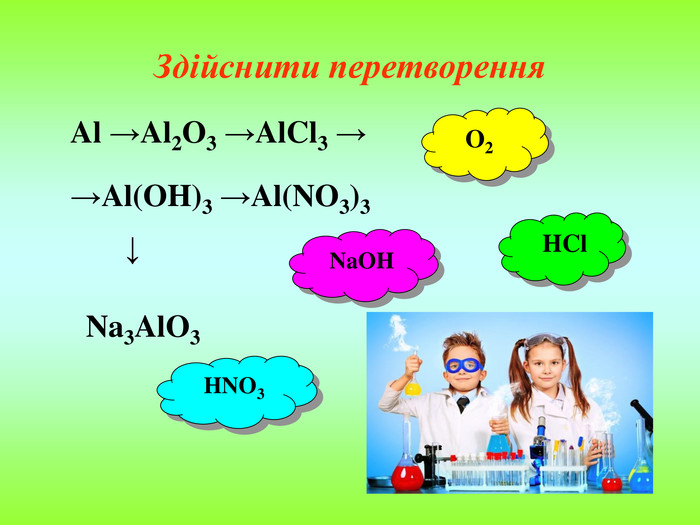
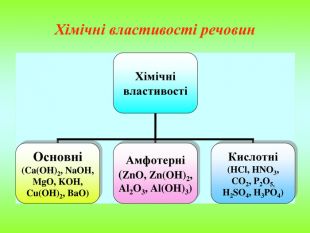
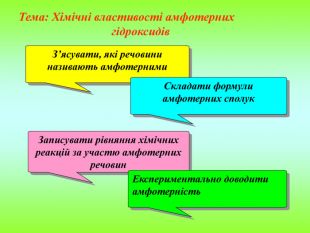
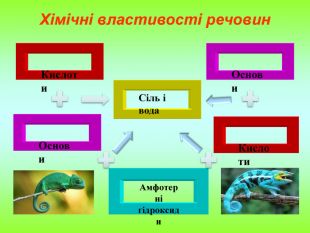
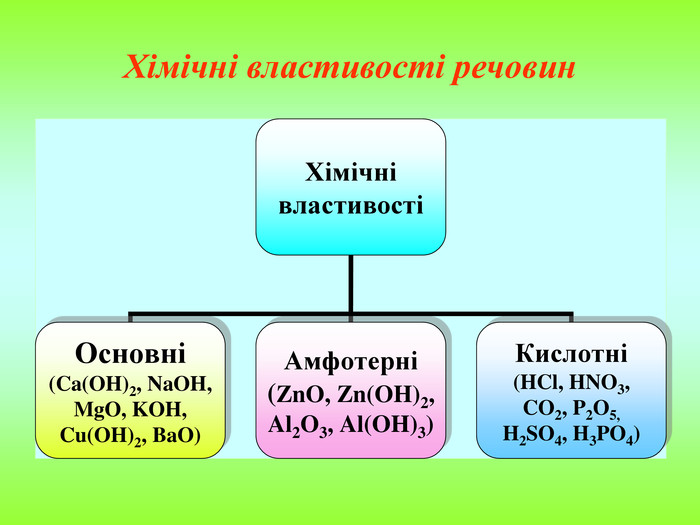
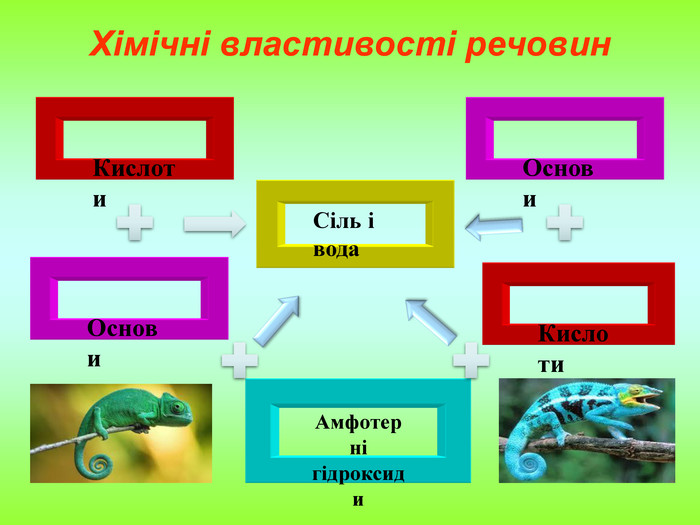
Презентація містить інформацію про фізичні і хімічні властивості амфотерних гідроксидів та їх застосування. Зміст архіву
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку






![Як основа: Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O основа кислота цинк сульфат Як кислота: H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O (в розплаві) кислота основа натрій цинкат Zn(OH)2 + 2 NaOH = Na2 [Zn(OH)4 ] (в розчині) натрій тетрагідроксоцинкат Цинк гідроксид – амфотерний гідроксид Як основа: Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O основа кислота цинк сульфат Як кислота: H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O (в розплаві) кислота основа натрій цинкат Zn(OH)2 + 2 NaOH = Na2 [Zn(OH)4 ] (в розчині) натрій тетрагідроксоцинкат Цинк гідроксид – амфотерний гідроксид](/uploads/files/321069/168088/180691_images/9.jpg)
![Як основний оксид ZnO + H2SO4 = ZnSO4 + 2H2O цинк сульфат Як кислотний оксид ZnO + 2NaOH = Na2ZnO2 + 2H2O (в розплаві) натрій цинкат ZnO + 2 NaOH = Na2 [Zn(OH)4 ] (в розчині) натрій тетрагідроксоцинкат Цинк оксид – амфотерний оксид Як основний оксид ZnO + H2SO4 = ZnSO4 + 2H2O цинк сульфат Як кислотний оксид ZnO + 2NaOH = Na2ZnO2 + 2H2O (в розплаві) натрій цинкат ZnO + 2 NaOH = Na2 [Zn(OH)4 ] (в розчині) натрій тетрагідроксоцинкат Цинк оксид – амфотерний оксид](/uploads/files/321069/168088/180691_images/10.jpg)


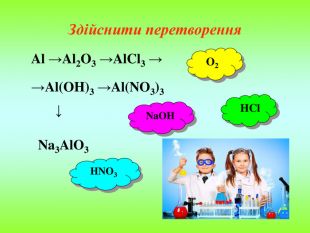
![Алюміній гідроксид виявляє амфотерні властивості і розчиняється як в кислотах, так і в лугах: Як основа Al(OH)3 + 3HCl → AlCl3 + 3H2O алюміній хлорид Як кислота Al(OH)3+ NaOH → Na[Al(OH)4]. (в розчинах) натрій метаалюмінат: Al(OH)3+ NaOH → NaAlO2+ 2H2O. (в розплавах) натрій метаалюмінат: Алюміній гідроксид – амфотерний гідроксид Алюміній гідроксид виявляє амфотерні властивості і розчиняється як в кислотах, так і в лугах: Як основа Al(OH)3 + 3HCl → AlCl3 + 3H2O алюміній хлорид Як кислота Al(OH)3+ NaOH → Na[Al(OH)4]. (в розчинах) натрій метаалюмінат: Al(OH)3+ NaOH → NaAlO2+ 2H2O. (в розплавах) натрій метаалюмінат: Алюміній гідроксид – амфотерний гідроксид](/uploads/files/321069/168088/180691_images/13.jpg)