Презентація "Хімічні властивості кислот"
Про матеріал
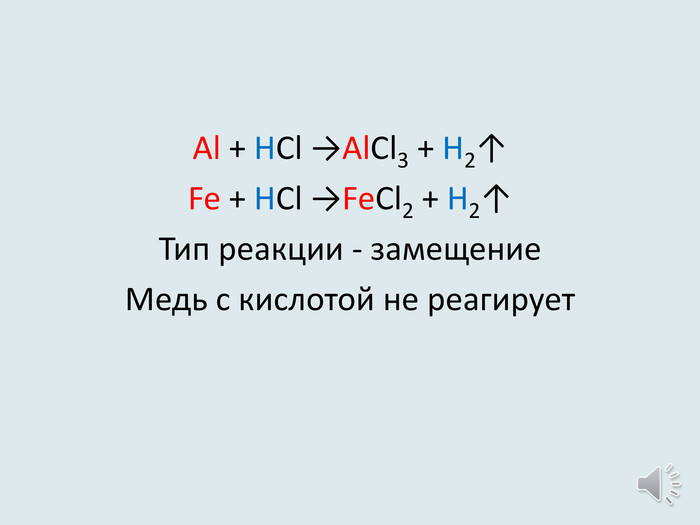
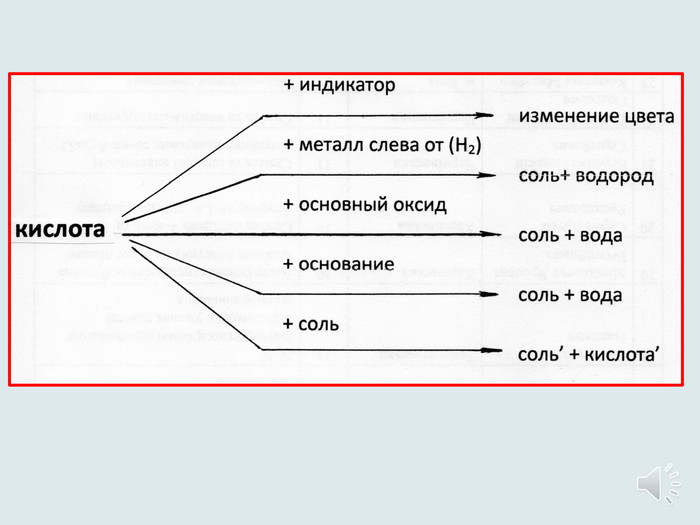
Презентація-видеоурок до уроку в 8 класах з теми "Хімічні властивості кислот: взаємодія з металами. Ряд активності металів. Реакції заміщення. Хімічні властивості кислот: дія на індикатори, взаємодія з основними оксидами, основами, солями.
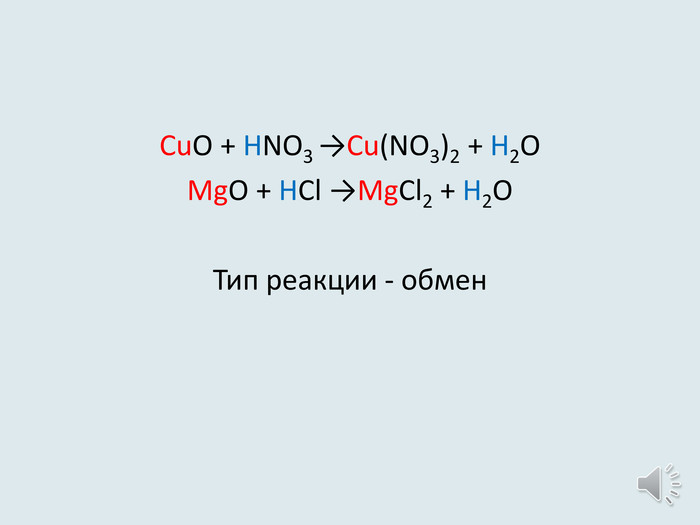
Реакції обміну."
Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку