Презентація "Амфотерні оксиди і гідроксиди
Про матеріал
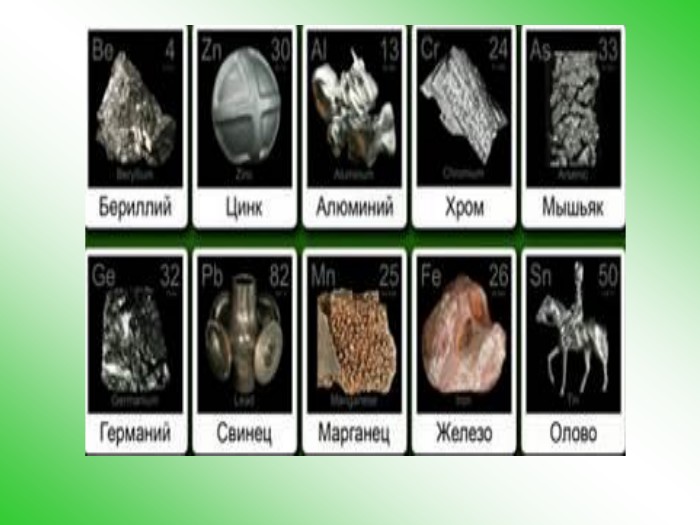
Презентація дає можливість розглянути поняття амфотерності як здатності сполук проявляти двоїсті властивості: і кислот, і основ;
розширити знання учнів про властивості основ і кислот на прикладі амфотерних сполук;
формувати вміння й навички складання рівнянь хімічних реакцій на прикладі амфотерних основ.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку













![Лабораторний дослід одержання і властивості амфотерного гідроксид ZnSO4 + 2NaOH= Na 2 SO4 +Zn(OH)2↓ Zn(OН)2 + 2HCl= 2H2O + ZnCl2 Zn(OН)2 + 2NaOH = Na 2 [Zn(OH) 4] Тетрагідроксоцинкат натрію ( комплексна сіль) Лабораторний дослід одержання і властивості амфотерного гідроксид ZnSO4 + 2NaOH= Na 2 SO4 +Zn(OH)2↓ Zn(OН)2 + 2HCl= 2H2O + ZnCl2 Zn(OН)2 + 2NaOH = Na 2 [Zn(OH) 4] Тетрагідроксоцинкат натрію ( комплексна сіль)](/uploads/files/199937/361348/414948_images/13.jpg)