Презентація "Амфотерні оксиди та гідроксиди"
Про матеріал
Презентація "Амфотерні оксиди та гідроксиди" є перекладеною з російської мови і допрацьованою з метою представлення цього досить складного матеріалу дітям на дистанційне вивчення протягом 2 уроків. Містить посилання на відеоматеріали. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




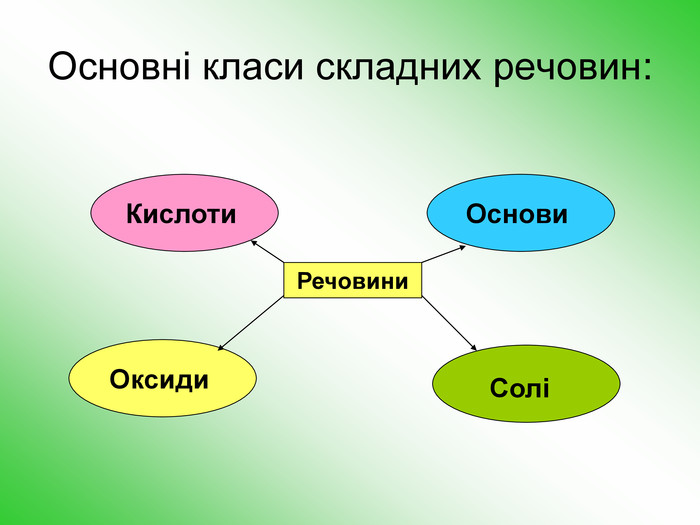


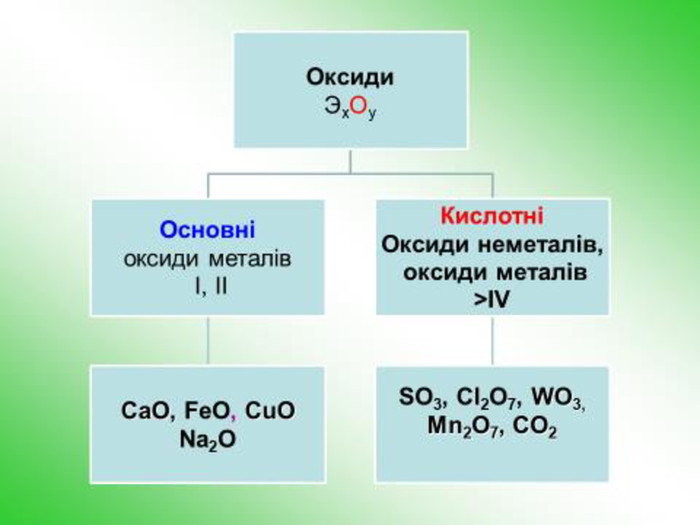

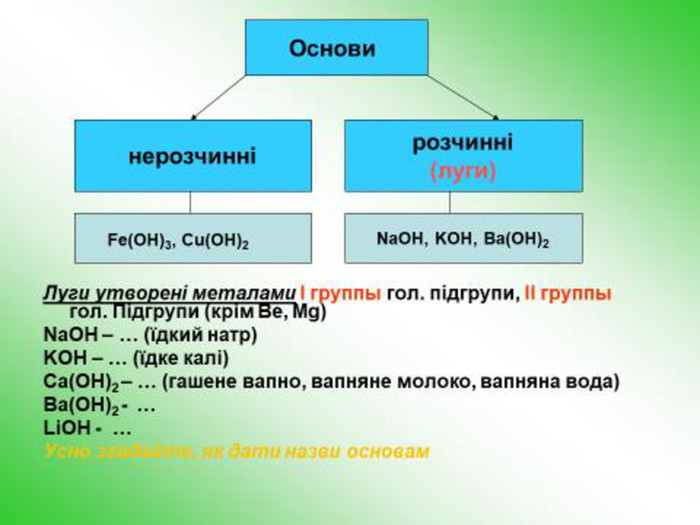






![З кислотою: Al(OH)3 + 3 HCl = Al. Cl3 +3 H2 OУ розчинах реакція з лугом : Al(OH)3 + 3 Na. OH = Na3[Al(OH)6]Алюміній хлорид. Натрій гексагідроксоалюмінат. Запишіть рівняння реакції:style.colorfillcolorfill.typefill.on З кислотою: Al(OH)3 + 3 HCl = Al. Cl3 +3 H2 OУ розчинах реакція з лугом : Al(OH)3 + 3 Na. OH = Na3[Al(OH)6]Алюміній хлорид. Натрій гексагідроксоалюмінат. Запишіть рівняння реакції:style.colorfillcolorfill.typefill.on](/uploads/files/350532/171999/184618_images/18.jpg)
![Як скласти формулу продукту реакціїAl(OH)3число після дужок множимо на 2 2×3=6заряд ОН- множимо на число після дужок (-1)×6= - 6 Al(OH)6до суммарного заряду додаємо заряд Аl3+ - 6+3= - 3[Al(OH)6]Дописуємо попереду стільки йонов Na+, щоб заряд дорівнював 0 -3+3=0 Na3[Al(OH)6]-6- 3 Як скласти формулу продукту реакціїAl(OH)3число після дужок множимо на 2 2×3=6заряд ОН- множимо на число після дужок (-1)×6= - 6 Al(OH)6до суммарного заряду додаємо заряд Аl3+ - 6+3= - 3[Al(OH)6]Дописуємо попереду стільки йонов Na+, щоб заряд дорівнював 0 -3+3=0 Na3[Al(OH)6]-6- 3](/uploads/files/350532/171999/184618_images/19.jpg)
![Як скласти назву продукту реакціїNa3[Al(OH)6]Натрій гексагідроксоалюмінат Як скласти назву продукту реакціїNa3[Al(OH)6]Натрій гексагідроксоалюмінат](/uploads/files/350532/171999/184618_images/20.jpg)



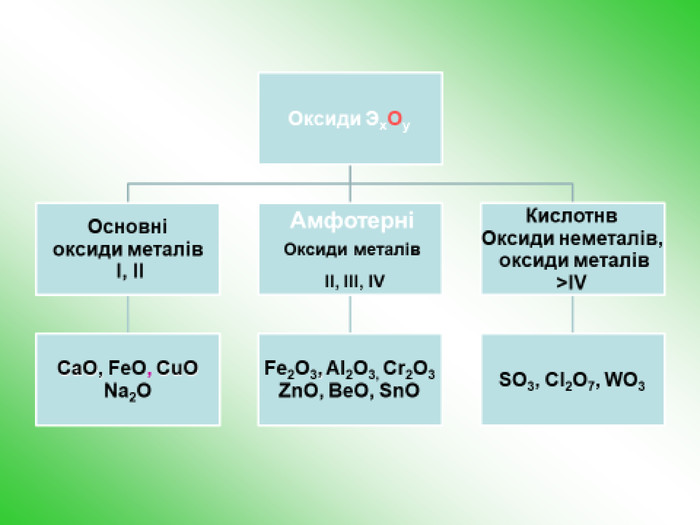








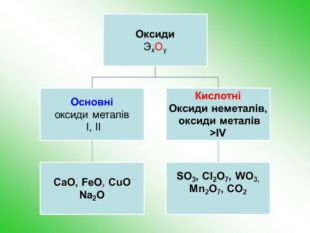
















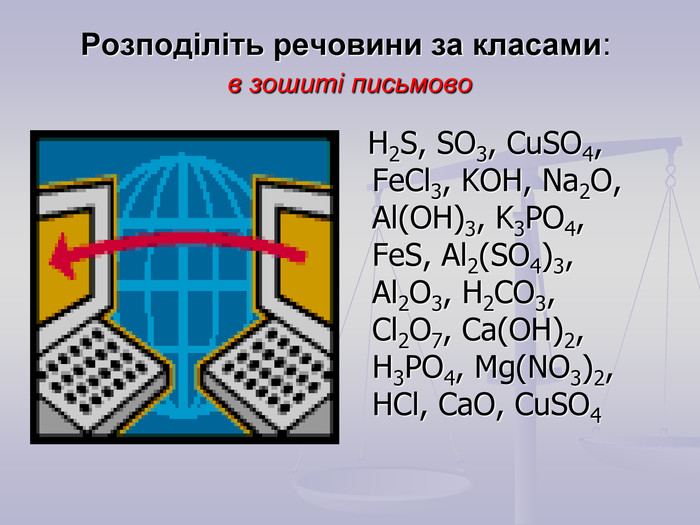
-

Фейзопуло Людмила Володимирівна
14.04.2024 в 09:58
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Чоп Наталя
02.04.2024 в 08:24
Чудово!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лобань Світлана Миколаївна
18.04.2022 в 11:50
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Промоскаль Анна Василівна
22.04.2021 в 23:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Деняк Oксана Миколаївна
06.04.2021 в 07:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Михайленко Лариса Анатоліївна
05.04.2021 в 09:17
Чудова презентація. Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
02.04.2021 в 08:55
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

фертак наталя
14.02.2021 в 21:18
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 5 відгуків