Презентація. Білки, їхня структурна організація та основні функції.
Про матеріал
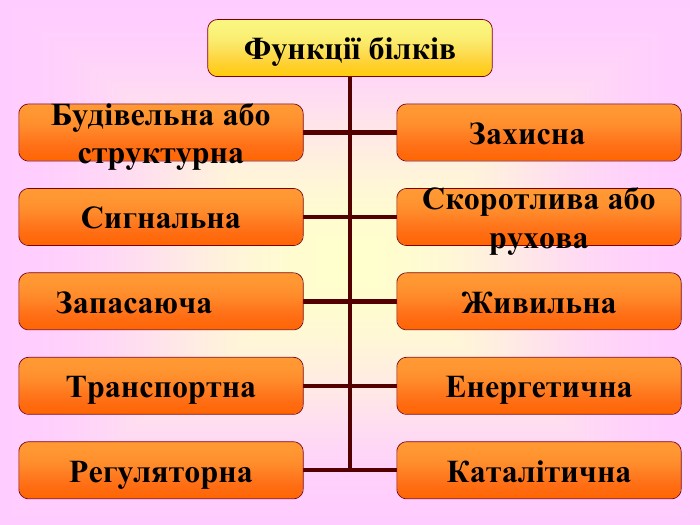
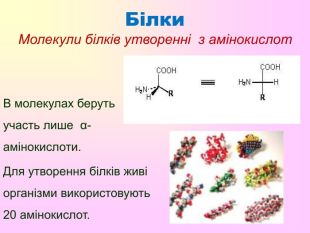
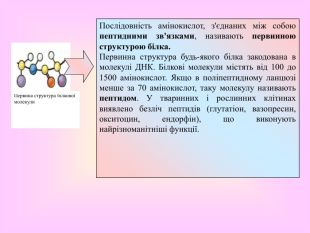
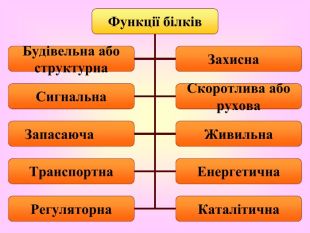
Мета.Формувати знання про білки, рівні їх структурної організації, , вивчити особливості будови, їх властивості та функції,встановлювати взаємозв’язки між будовою та функціями білків. Розвивати уміння логічно мислити, спостерігати та робити відповідні висновки,сприяти розвитку вміння долати труднощі, розвивати пізнавальні можливості, самостійність, самовдосконалення, увагу, пам’ять, формувати оптимальний харчовий раціон; Виховувати позитивне ставлення до навчання, пробудити в пізнавальній, творчій, прививати культуру поведінки в колективі, повагу до думки іншого.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку