Презентація "Будова атомних ядер"
Про матеріал
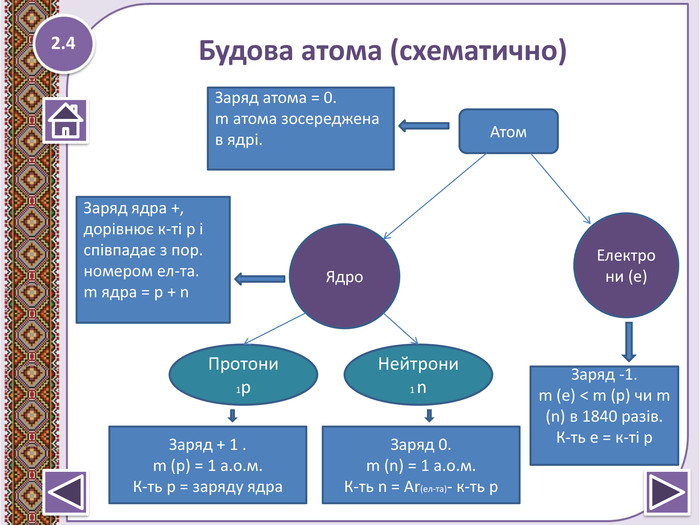
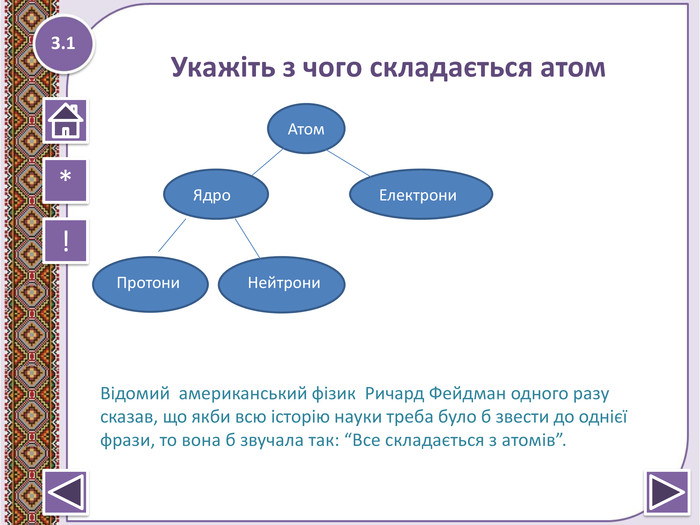
Презентація "Будова атомних ядер" з урахуванням останніх вимог.
З систаматизацією опорних знань, поданням нового матеріалу та невеличкою роботою на перевірку засвоєних знань. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку