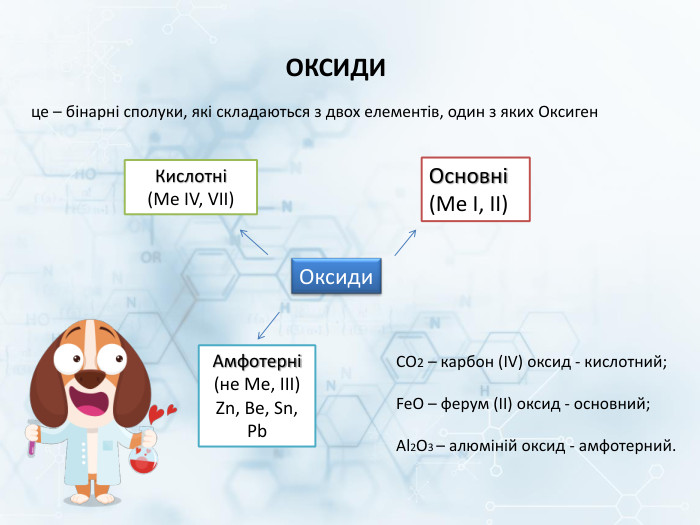
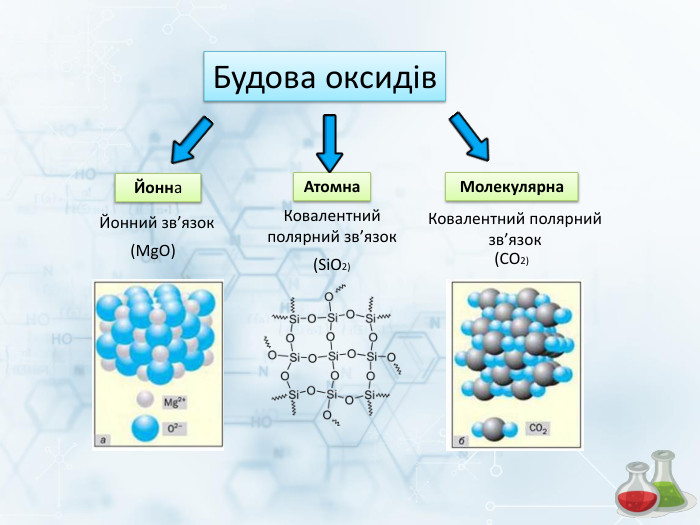
Презентація "Будова, властивості та використання оксидів" 8 клас
Про матеріал
Презентація допоможе в проведенні уроку, а саме: сконцентрує увагу учнів та підсилить візуальну пам’ять Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку