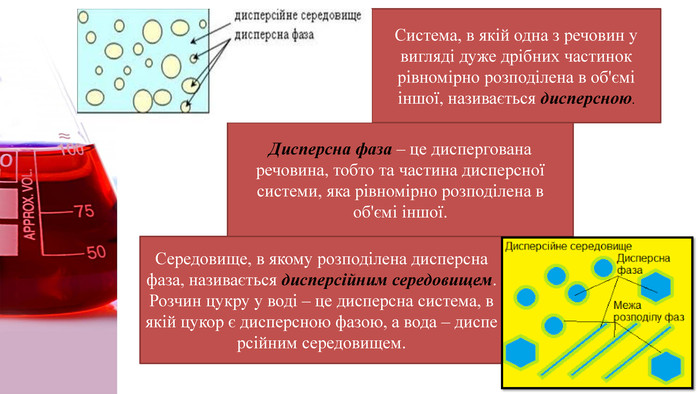
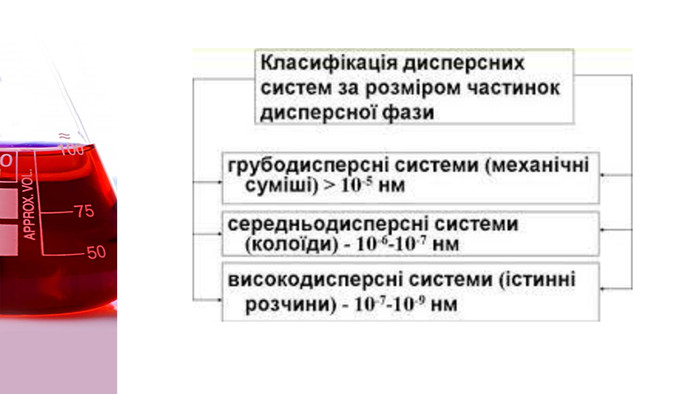
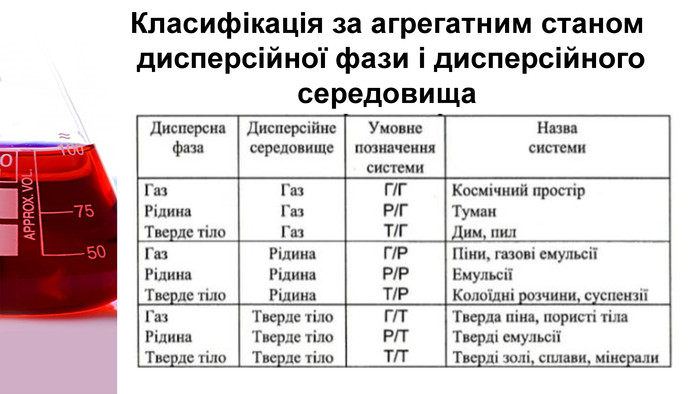
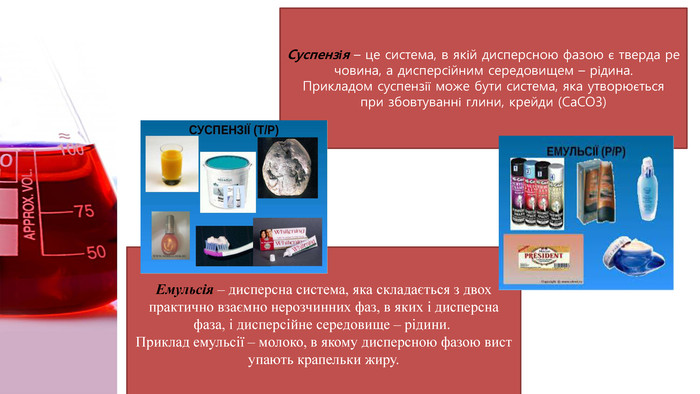
Презентація "Дисперсні системи та їх класифікація."
Про матеріал
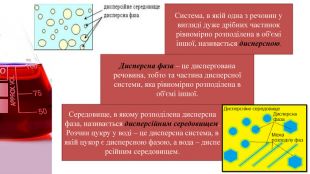
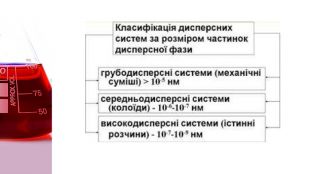
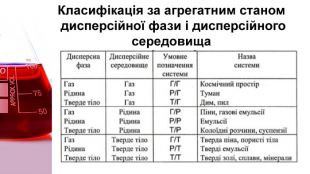
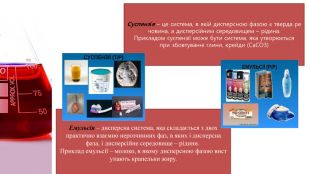
Зрозуміти що таке дисперсна система, види дисперсних систем, яке значення мають істинні розчини, колоїдні розчини і грубодисперсні системи. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку