Презентація для учнів 11 класу, рівень стандарт "Періодичний закон і періодична система Д.І.Менделєєва"
Про матеріал
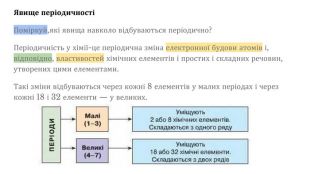
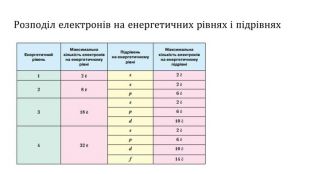
Презентаційний матеріал з теми "Періодичний закон і періодична система Д.І.Менделєєва" дозволить сформулювати сучасне визначення періодичного закону, дасть підгрунття для повторення атомної будови, навчить розраховувати максимальну кількість електронів на енергетичному рівні, розкриє поняття орбіталь та типи орбіталей.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку