Презентація з хімії для учнів 11 класу, рівень стандарт "Явище періодичної зміни властивостей елементів та їхніх сполук на основі уявлень про електронну будова атомів"
Про матеріал
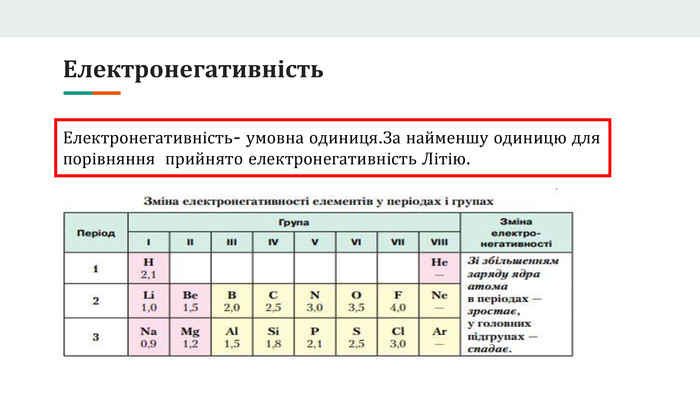
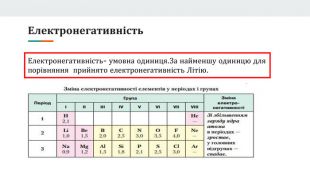
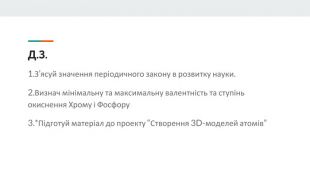
Презентація розроблена як допоміжний матеріал до уроку хімії з теми "Явище періодичної зміни властивостей елементів та їхніх сполук на основі уявлень про електронну будова атомів". Вона висвітлює такі поняття,як радіус атома, валентність, ступінь окиснення.Дає ключові знання для розуміння чому елементи періодично змінюють свої власивості та дає змогу порівнювати атомну будову металів та неметалів. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку