Презентація до курсу "Хімія у побуті" "Кислоти"
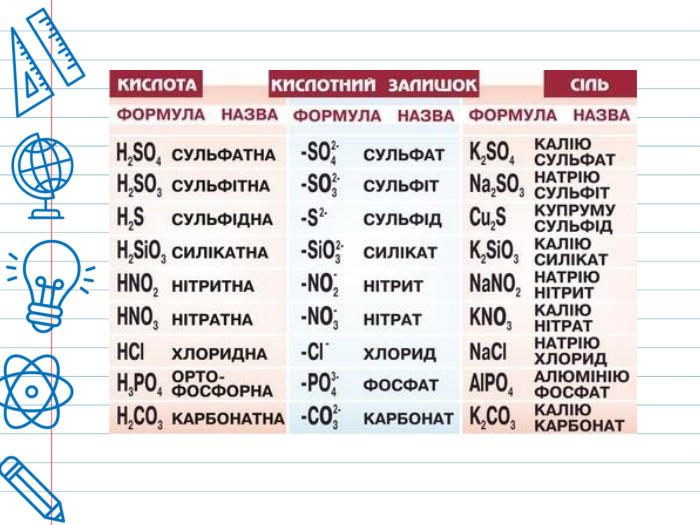


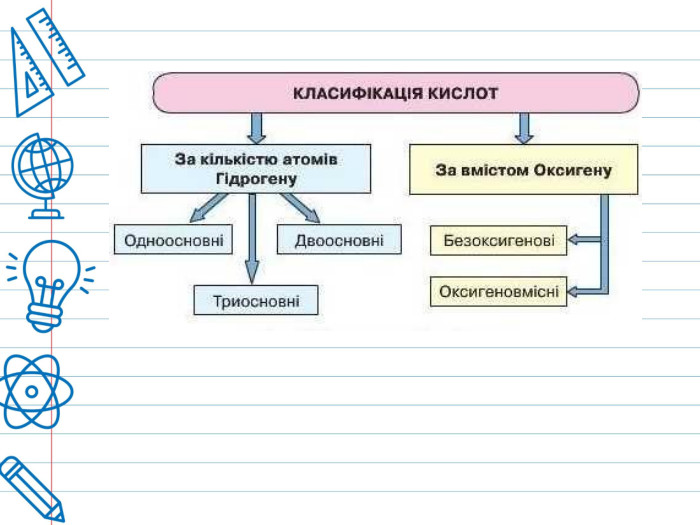
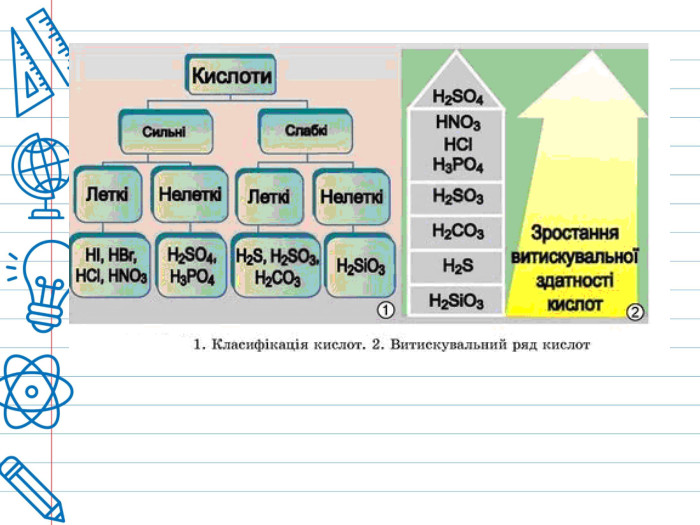
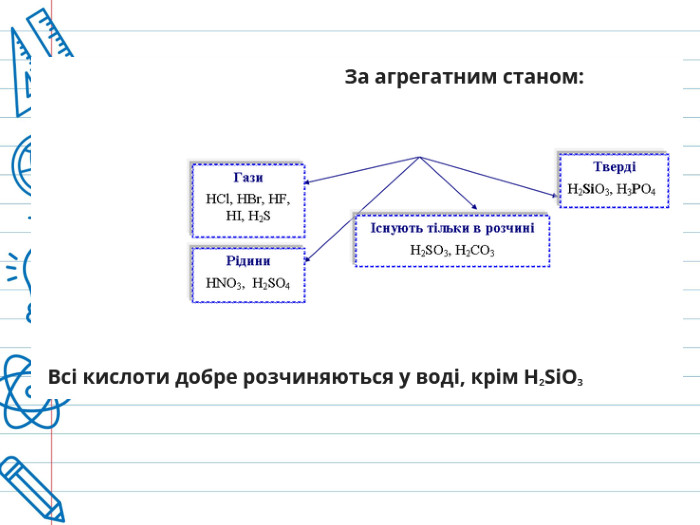
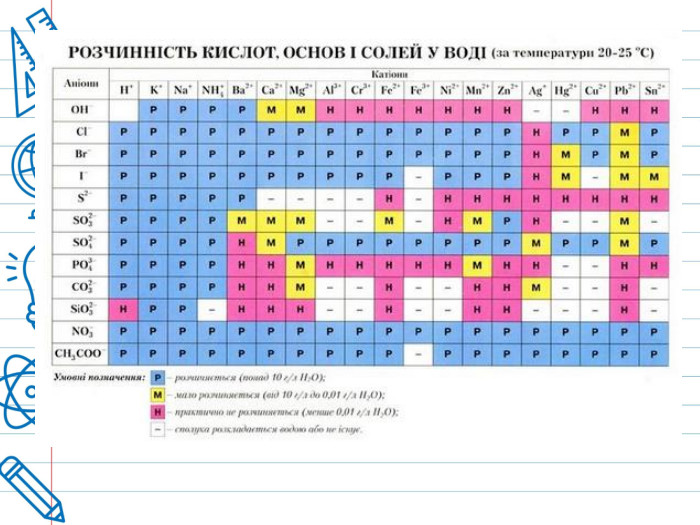
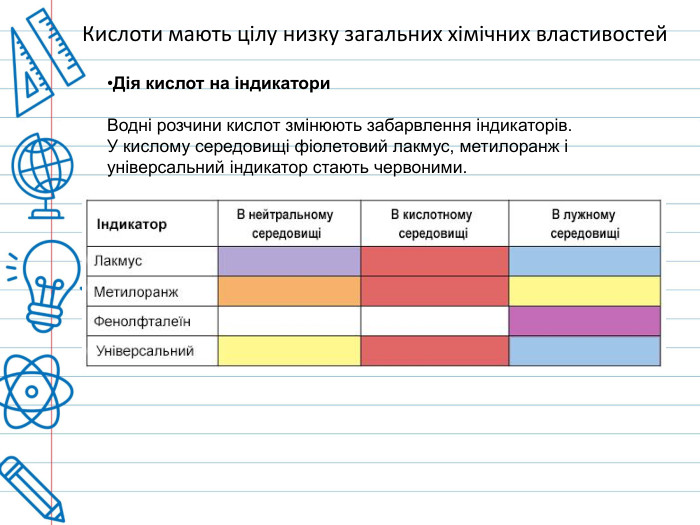
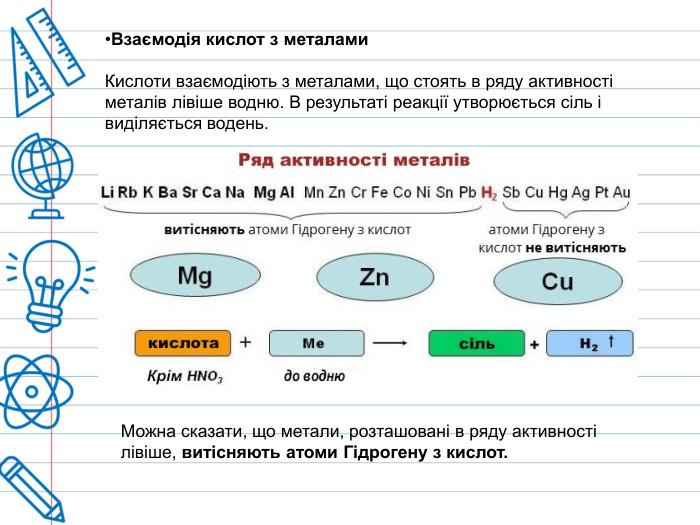







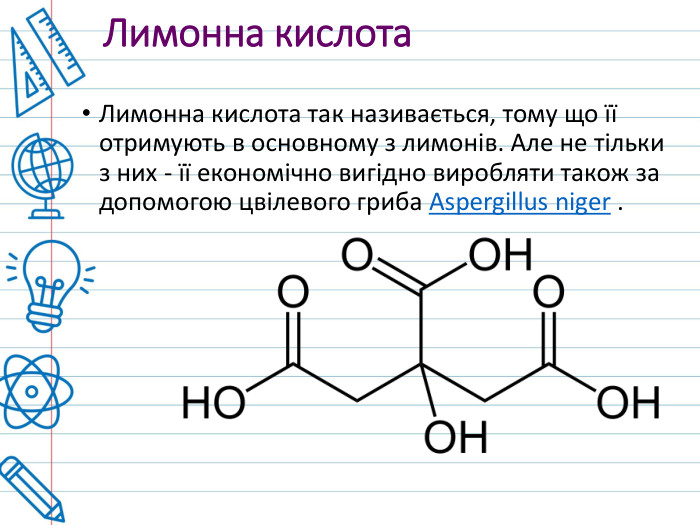























































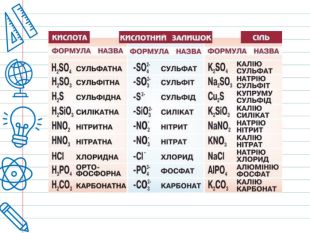
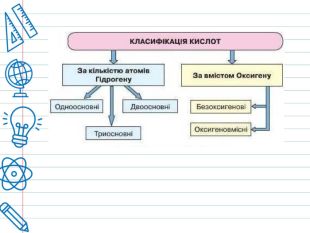
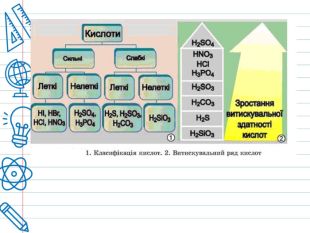
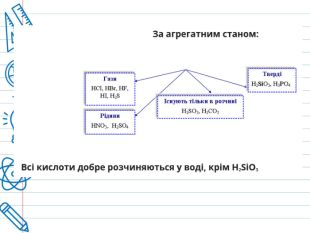
Кислота - це складна речовина, в молекулі якого є один або кілька атомів водню і кислотний залишок. Слова "кислота" і "кислий" не дарма мають спільне коріння. Розчини всіх кислот на смак кислі. Це не означає, що розчин будь-кислоти можна пробувати на смак - серед них зустрічаються дуже їдкі і навіть отруйні. Але такі кислоти як оцтова (міститься в столовому оцті), яблучна, лимонна, аскорбінова (вітамін С), щавлева і деякі інші (ці кислоти містяться в рослинах) знайомі вам саме своїм кислим смаком. Всі кислоти, незалежно від їх походження, об'єднує загальна властивість - вони містять реакційноздатні атоми водню.
Взаємодія кислот з основними і амфотерними оксидами Кислоти реагують з основними і амфотерними оксидами. У результаті реакції утворюється сіль і вода. Наприклад, при взаємодії основного кальцій оксиду з нітратною кислотою утворюється сіль кальцій нітрат, а при взаємодії амфотерного алюміній оксиду з сульфатною кислотою утворюється сіль алюміній сульфат: Ca. O+2 HNO3=Ca(NO3)2+H2 O;Al2 O3+3 H2 SO4=Al2(SO4)3+3 H2 O.
Взаємодія кислот з основами і з амфотерними гідроксидами Кислоти реагують з основами і з амфотерними гідроксидами, утворюючи сіль і воду. Так само, як і в попередньому прикладі, при взаємодії натрій гідроксиду і алюміній гідроксиду з кислотами утворюються відповідні солі: Na. OH+HNO3=Na. NO3+H2 O;Al(OH)3+3 HCl=Al. Cl3+3 H2 O. Реакції між кислотами і основами називають реакціями нейтралізації.
Наприклад, при взаємодії розчину сульфатної кислоти з розчином кальцій хлориду в осад випадає кальцій сульфат, а при взаємодії розчину калій силікату з розчином нітратної кислоти в осад випадає силікатна кислота: H2 SO4+Ca. Cl2=Ca. SO4↓+2 HCl;K2 Si. O3+2 HNO3=H2 Si. O3↓+2 KNO3. Продукт реакції при звичайних умовах, або при нагріванні випаровується. Наприклад, при дії хлоридної кислоти на ферум(II) сульфід виділяється газ гідроген сульфід: Fe. S+2 HCl=Fe. Cl2+H2 S↑.
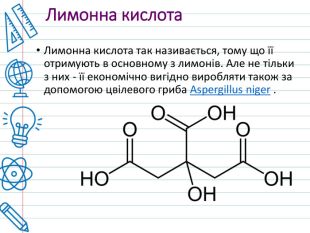
З тонни лимонів можна отримати до 25 кг лимонної кислоти. Лимонна кислота вперше була виділена (з соку лимонів) в 1784 році шведським аптекарем Карлом Шеєле. В організмі кожної людини міститься лимонна кислота. Незважаючи на лимонну назву, ця кислота в природі зустрічається у великій кількості плодів і рослин. Приклад: цитрусові, китайський лимонник, ананаси, гранати, хвоя, а також добре знайомі багатьом нашим співвітчизникам журавлина, горобина або смородина.
Використання. Лимонна кислота застосовується як смакова добавка, регулятор кислотності і консервант, також для виробництва напоїв. Завдяки своїм властивостям лимонна кислота, наприклад, підвищує строк зберігання маргарину, тваринних жирів і жирів. У медицині, лимонна кислота входить до складу засобів, які покращують енергетичний обмін. У косметиці, лимонна кислота застосовується як регулятор кислотності, хелатуючий агент.
У нафтовій промисловості, лимонна кислота використовується для нейтралізації високого рівня p. H бурового розчину. При прийомі всередину в невеликих дозах лимонна кислота сприяє прискоренню метаболізму. Але в дуже великих кількостях небезпечна і призводить до опіків травного тракту. Лимонну кислоту краще не вживати людям, у яких алергія на цитрусові. Також вона може викликати карієс. У будівництві, лимонну кислоту використовують як добавки до цементу для уповільнення зчеплення.
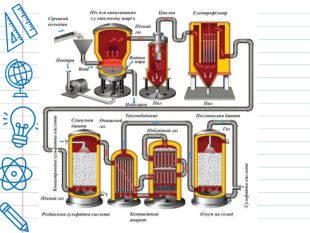
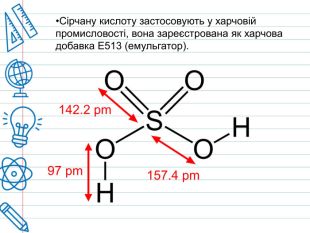
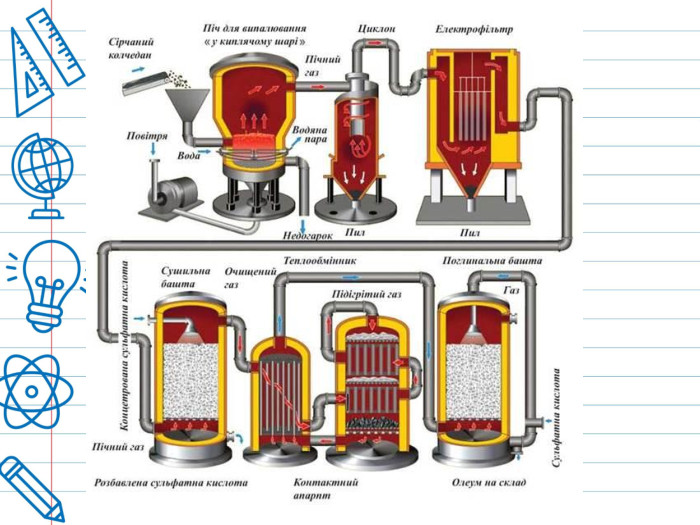
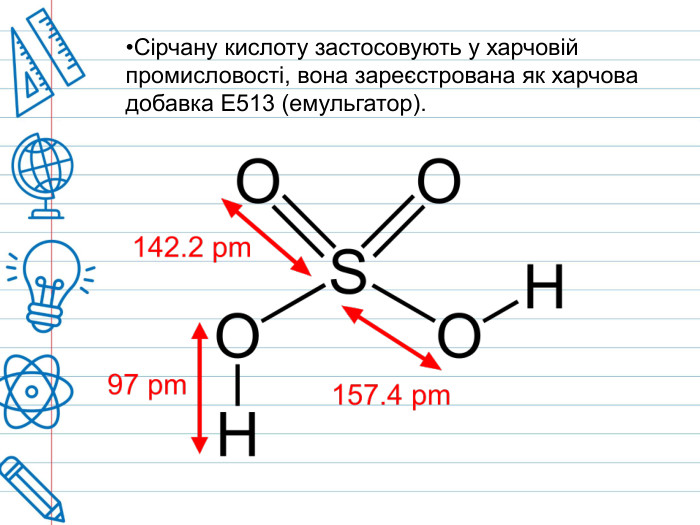
Сірчана кислота По «артеріях» хімічних підприємств тече «їдка кров» –сірчана кислота (або сульфатна). Вона «годує» широке коло галузей економіки, за що її прозвали «хлібом» світової хімічної індустрії. Зі шкільної лави багато хто пам’ятає її під формулою H2 SO4 – нічим на перший погляд не примітна неорганічна сполука, що вступає проте в реакцію з іншими речовинами. За звичайних умов концентрована сірчана кислота — важка масляниста рідина без кольору та запаху, із сильнокислим «мідним» смаком. Застаріла назва – купоросна олія.
Сірчана кислота синтезується самою природою. Одна з визначних пам’яток Сицилії (Італія) – озеро, з дна якого просочується H2 SO4. Чому так відбувається? У земній корі міститься сировина для її синтезу – пірит, що містить в собі сірку. Якщо говорити простими словами, то пірит вступає в реакцію з водою, в результаті якої вивільняє сірку, яка, в свою чергу, сама з’єднується з водою і утворює слабкий розчин сірчаної кислоти. Але навіть і такої концентрації цілком достатньо, щоб з часом розчинити все, що потрапить до неї. Тому всі живі істоти, включаючи рослини, цураються озера смерті.• Ходять легенди, що цей вищезгаданий небезпечний резервуар сірчаної кислоти використовувався сицилійською мафією для приховування слідів своєї злочинної діяльності – в озеро вони кидали трупи вбитих, від яких незабаром не залишалося жодної кісточки.
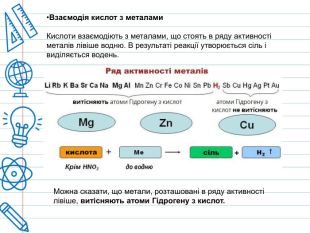
При дії розведеної сульфатної кислоти на метали, які у електрохімічному ряді активності металів розташовані ліворуч водню, виділяється водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна реагувати, при нагріванні, навіть з благородними металами, такими як мідь, ртуть і срібло, хоча при цьому вона не взаємодіє з залізом та деякими іншими металами через їх пасивацію. Тому для перевезення концентрованої сульфатної кислоти використовуються залізні цистерни.
Реакційна здатність розведеної сульфатної кислоти з металами різної електронегативності: алюміній (Al) окиснюється найлегше, цинк (Zn) та залізо (Fe) активно виділяють водень, в той час як свинець (Pb) пасивується через утворення плівки нерозчинного сульфату, а електронегативна мідь (Cu) майже не реагує.
Сусідня планета з красивим жіночим ім’ям «Венера» (богиня краси і любові в римській міфології) виявилася найгарячішою і найотруйнішою з усіх планет Сонячної системи. Температура атмосферного повітря тут перевищує 400 °С, і здатна розплавити навіть свинець, а за своїм складом атмосфера на 90% складається з вуглекислого газу (CO2). Під час грози скупчення діоксиду вуглецю перетворюються на H2 SO4. Тому на Венері випадають опади у вигляді крапель сірчаної кислоти. Мало кому захочеться гуляти під таким дощем.
Чому людина плаче, коли чистить або шаткує цибулю? Виявляється, в цибулині міститься особлива речовина – лакриматор. Вона виділяється при розрізанні цибулі, потрапляє на кон’юнктиву очей і швидко розчиняється у слізній рідині. В результаті такої хімічної реакції утворюється сірчана кислота, яка подразнює слизову оболонку. Насправді це своєрідний захисний механізм цієї овочевої культури: неприємний запах і смак відштовхують тварин і комах, і вберігають її від поїдання. .
Не тільки змії вміють вистрілювати в свою жертву отруту і паралізувати її таким чином. На вигляд неповороткі і нешкідливі молюски (наприклад, глибоководні Dolium – морські равлики з красивою раковиною) полюють за морськими зірками, гребінцями, їжаками. Як з ними впоратися, коли у кожного з них є твердий вапняний панцир? У їдкій слині молюска міститься сірчана кислота, здатна розчинити тверді частинки скелета до стану гіпсу.
Світове виробництво сірчаної кислоти становить близько 200 мільйонів тонн на рік. Найбільшими споживачами сірчаної кислоти є виробники мінеральних добрив. Тому сірчанокислотні заводи прагнуть будувати в комплексі із заводами з виробництва міндобрив. Залізничні цистерни для перевезення сірчаної кислоти
Близько 20 % всього виробництва сульфатної кислоти використовується в хімічній промисловості для виробництва миючих засобів, синтетичних смол, барвників, фармацевтичних препаратів, інсектицидів, антифризу, а також для різних технічних процесів. Близько 6 % використовують для виробництва пігментів, фарб, емалей, типографських фарб. Використовується також як осушувач газів.
Сірчана кислота діє як електроліт в свинцево-кислотних акумуляторах. Сірчана кислота є кислотним каталізатором для перетворення циклогексанону оксиму в капролактам, який використовується для виготовлення капрону. Вона використовується для виготовлення соляної кислоти з солі. Сульфатна кислота використовується в нафтопереробній промисловості, як каталізатор реакції ізобутану та ізобутилену, для утворення ізооктану, сполуки, що має еталонне октанове число, і придатної для створення високооктанового бензину без металовмісних присадок. Сірчана кислота використовується у великих кількостях у металургійній промисловості для видалення окислення, іржі та накипу з листового прокату.
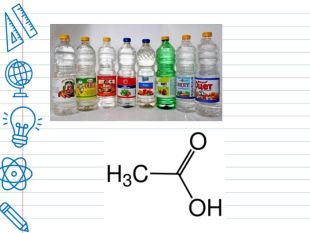
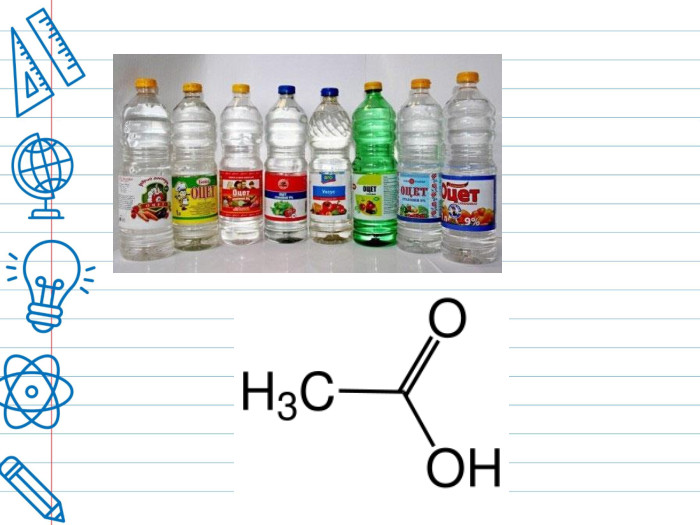
Оцтова кислота. Оцет - одна із найдавніших приправ, яка до сьогодні не втратила своєї популярності. Але називати цю кислу рідину тільки приправою буде не зовсім правильно. Оцет - незамінний компонент, у консервації, основа маринадів та соусів, дезінфікуючий засіб. Ще більше 4000 років тому в Стародавньому Єгипті та інших країнах вміли готувати вино з виноградного соку, при скисанні якого утворювався оцет. Ним як харчовою приправою вміли користуватися майже 3000 років тому. Назва оцет ототожнювалася з самим поняттям про кисле та кислоти. Саме слово “кислий”, “кислота” походить від лат. аcetum – “оцет”, аcіdum –”кислий”.
Різновиди оцту. Синтетичний оцет (столовий) отримують в результаті розведення концентрованої синтетичної оцтової кислоти. Натуральний оцет отримують із харчової спиртовмісної сировини в результаті мікробіологічного синтезу з допомогою оцтовокислих бактерій Acetobacter aceti. У результаті в готовому продукті виявляється не тільки оцтова кислота, але і яблучна, молочна, лимонна, аскорбінова, невелика кількість складних ефірів, альдегідів, пектинових речовин та інших органічних сполук, які надають харчового оцту особливий м'який смак і приємний аромат. Бальзамічний оцет: королем всіх оцтів можна вважати бальзамічний оцет – це різновид винного оцту, але готують його по більш складній технології із сортів винограду з підвищеним вмістом цукру. Після ферментації й випарювання оцет поміщають у дерев'яні бочки, де він ще не менш 12 років «доходить», здобуває колір, смак, запах і щільність. Цей оцет називають бальзамічним тому, що спочатку його використовували переважно в медичних цілях.
Посудину з льодяною оцтовою кислотою, яку принесли з холодного складу, доводиться ставити на добу біля теплої батареї, щоб кислота розплавилася. Тільки потім її можна наливати із посудини. Переливати оцтову кислоту теж непросто, тому що вона має різкий подразнюючий запах, а при попаданні на шкіру дає опіки. Доводиться користуватися респіратором і гумовими рукавичками. Перша допомога при опіках - рясне промивання водою. Синтетична харчова оцтова кислота – легкозаймиста рідина її зберігають у герметичних резервуарах із нержавіючої сталі.
У деяких країнах існують музеї, присвячені винятково оцту. Наприклад, в 2001 році був відкритий перший у Китаї Музей оцту на березі гарного озера в провінції Шаньси. За зовнішнім виглядом музей схожий на вежу (9 поверхів), що піднімається на великій площі. У ньому експонуються матеріали про історію розвитку оцту й більше 200 оригінальних речей для виготовлення, зберігання й транспортування оцту. У провінції Шаньси, що називають «столицею оцту», існує особлива культура пиття оцту і його приготування. Є подібний музей оцту й у Південній Дакоті (США). Там є що подивитися для тих, хто цікавиться оцтом. Музей заснував стипендію для студентів, що спеціалізуються на дослідженнях оцту.
Жирний посуд, сковорідки легше вимити, якщо у воду додати трохи оцту. Так само перуться кухонні рушники, відмиваються губки й щітки. Досить у воду влити трохи оцту і надтріснуте яйце не витече під час варіння. Свіжі яблука не потемніють, якщо очищені скибки покласти у злегка підкислену оцтом воду. Щоб картопля (чищена) не чорніла, додайте у воду трохи оцту. Запах риби, цибулі, часнику, квашеної капусти чи оселедця зникне, якщо посуд сполоснути водою з оцтом. Зів´яла зелень петрушки, селери чи кропу стане свіжою, якщо покласти її у воду з оцтом. Волосся після миття добре ополіскувати водою з оцтом. Волосся буде м´яким і блискучим.Іржаві плями можна вивести міцним розчином оцтової есенції (1 чайна ложка на 1\2стакану води). В підігрітий розчин кислоти на декілька хвилин опускають забруднену частину одежі, після чого добре прополіскують водою.
У стародавній легенді розповідається, що цариця Клеопатра виграла оригінальне парі, з´ївши „сніданок”, який коштував 100 000 систерцій (дуже велика сума). Ось як це описано в повісті Г. Хаггарда „Клеопатра – володарка зорі”: „... Вона вийняла з вуха одну з величезних перлин...і... опустила її в оцет. Запала мовчанка, вражені гості, завмерши, спостерігали, як незрівнянна перлина повільно розчиняється в міцному оцті. От від неї не залишилось і сліду, і тоді Клеопатра підняла кубок, покрутила його, і випила весь до останньої краплі.” На полотні «Бенкет Клеопатри» зображено композицію улюбленого сюжету Джованні Тьєполо. Клеопатра, єгипетська цариця, знявши із себе перлину небаченої величини, показує її цезарю Антонію перед тим, як опустити в келих з оцтом (його тримає вартий позаду мавр). Клеопатра, розстаючись із безцінним скарбом, показує своєму коханому, що ніщо у світі, крім його любові, нецінне для неї.
Застосування оцтової кислоти. Оцтова кислота - один з базових продуктів промислового органічного синтезу. Більш ніж 65 % світового виробництва оцтової кислоти йде на виготовлення полімерів, похідних целюлози та вінілацетату. Оцтову кислоту використовують у виробництві органічного скла, киноплівки; для синтезу барвників, медикаментів і складних ефірів, у виробництві негорючих плівок, парфумерних продуктів, розчинників, при синтезі барвників, лікарських речовин, наприклад, аспірину. З ацетатної целюлози виготовляють ацетатне волокно. Оцтова кислота та її естери важливі промислові розчинники та екстрагенти. Солі оцтової кислоти використовують із боротьби з шкідниками рослин.
Борну кислоту відкрили в першій половині XVIII ст. і вона відразу стала дуже популярною. На незв'язану кислоту можна натрапити в деяких вулканічних місцевостях таких, як Тоскана, Ліпарські острови і Невада. Її також можна виявити в складі багатьох мінералів (бура, борацит і колеманіт). Борну кислоту та її солі знайдено в морській воді. Вона також є в рослинах і майже у всіх овочах (яблука, сливи, груші і т. д.).
Борну кислоту широко використовують в медицині як слабкий антисептичний засіб: у вигляді 1—2%-вого водного розчину — для промивання ран; у порошку — для лікування носа й вуха; у спиртових розчинах і мазях — для лікування шкіри. Крім того, борну кислоту застосовують для дублення шкіри, у виробництві скла, виготовленні деяких фарб та емалей.
У переліку найбільш популярних сфер застосування борної кислоти: Боротьба зі шкідниками Добриво для сільськогосподарських культур Ковальська справа: кування, спаювання та зварювання, гальваніки Виготовлення скловолокна та інших скляних виробів, кераміки Мийні засоби Борна кислота як інсектицид у боротьбі з тарганами, блохами, мурахами
Чому борна кислота така ефективна у боротьбі з тарганами? Крихітні частинки порошку борної кислоти осідають на тільце шкідника і проникають всередину, коли комаха очищує порошок з лап і вусиків. Частина борної кислоти також всмоктується через зовнішній хітиновий покрив тіла комахи. Борна кислота діє, як шлункова отрута, впливаючи на обмін речовин комах, порошок борної кислоти володіє також абразивними властивостями, вбиваючи комах, діючи на їх екзоскелети.
Добриво: які рослини і чому потребують борної кислоти найбільше? Борна кислота під час потрапляння в грунт легко переходить в грунтовий розчин. Бор дуже сорбується ґрунтами. Аніони бору добре утримуються глинами, особливо мінералами групи ілліту, оксидами, органічними речовинами. Серед мікроелементів земляного покриву бор є найбільш рухливим в грунті. Його наявність та поширення в грунті значно залежить від потоку води, навіть в холодних кліматичних зонах бор вимивається вниз.
Виготовлення скловолокна за допомогою борної кислоти Борна кислота є джерелом оксиду бору в багатьох скляних виробництвах, зокрема, для виготовлення, боросилікатного скла спеціального призначення, ізоляційного і текстильного скловолокна. У технологічному процесі виробництва скла борна кислота сприяє плавленню шихти, зменшує в'язкість розплаву, перешкоджає розсклінню, що призводить до збільшення міцності, стійкості до механічного, хімічного і термічного впливу кінцевого продукту. При виробництві скловолокна і склотканини застосування борної кислоти сприяє процесу волокноутворення, що призводить до зміцнення скловолокна, хімічної стійкості, поліпшення тепло- і звукоізоляційних характеристик. Боросилікатне скло має містити не менше 5% оксиду бору. Воно стійке до екстремальних температур, а також до хімічної корозії. Саме це дозволяє використовувати боросилікатне скло для лабораторного вживання. Багато лінз для мікроскопів і телескопів виготовлені саме з боросилікатного скла.
Борна кислота для пайки застосовується в складі флюсів. Найбільш вживаним і універсальним флюсом для пайки виробів з золота є водний розчин борної кислоти і бури в пропорції 1:1. Наприклад, для того, щоб приготувати цей флюс, береться по 20гр. бури і борної кислоти, перемішується з 200мл. води (бажано дистильованої), потім нагрівається і доводиться до кипіння. Після того, як охолоне, можна використовувати. Так само борна кислота використовується в складі флюсів для пайки виробів з нержавіючої сталі.
Використання в ядерних реакторах. Борну кислоту у вигляді водного розчину використовують у ядерних реакторах з водою під тиском (водно-водяні реактори). У цьому типі реакторів водний розчин борної кислоти використовують, як поглинач нейтронів внаслідок вмісту у кислоті елементу Бору. У природі елемент бор має два ізотопи — В10 (20 % вмісту) та В11 (80 % вмісту). Для поглинання нейтронів потрібен високий абсорбційний коефіцієнт і тому, як поглинач нейтронів краще використовувати ізотоп В10 для управління ядерною реакцією та її потужністю у реакторі.
Хлоридна кислота. Хлоридна кислота, також: соляна кислота, хлороводнева кислота — розчин хлороводню (HCl) у воді. Соляна кислота є типовою кислотою. За своєю хімічною активністю вона належить до найсильніших кислот. Подібно до інших сильних кислот вона активно розчиняє більшість металів з виділенням водню, взаємодіє з оксидами металів тощо.
Важко сказати, хто і коли вперше отримав соляну кислоту. Відомо, що вже в кінці XV ст. алхімік Василь Валентин і в XVI ст. Андреас Лібавій в старанних пошуках чудодійного життєвого еліксиру прожарювали у своїх алхімічних приладах кухонну сіль з галуном і купоросами і отримали продукт, який описали під назвою «кислого спирту». Це і була знайома тепер нам соляна кислота, дуже нечиста. Для перших дослідників це була абсолютно нова речовина, що володіла властивостями, які сильно вражали їх уяву. Нюхаючи її, вони задихалися і кашляли, «кислий спирт» димів у повітрі. При пробі на смак, вона обпалювала язик і піднебіння, метали вона роз'їдала, тканини руйнувала.
У 1658 р. німецький хімік Й. Глаубер (1604–1670) знайшов новий спосіб отримання соляної кислоти, яку він назвав «соляним спиртом». Спосіб цей широко застосовується досі в лабораторіях. Він нагрівав кухонну сіль з концентрованою сірчаною кислотою і «дим», що виділявся та поглинав водою. У 1772 р. англійський хімік Джозеф Прістлі (1733–1804) встановив, що при дії сірчаної кислоти на кухонну сіль виділяється безбарвний газ, який може бути зібраний над ртуттю, і що цей газ має надзвичайно велику здатність розчинятися у воді. Водний розчин цього газу отримав назву «соляної кислоти» (acidum muriaticum), а сам газ Прістлі назвав «чистою газоподібною соляною кислотою».
Соляна кислота широко використовується у народному господарстві. Найбільше застосовується вона у хімічній промисловості для добування різних солей: хлориду цинку, хлориду барію та ін., а також для виробництва барвників, лікувальних речовин тощо. Багато хлоридної кислоти споживає також металургійна промисловість для виділення кольорових і рідкісних металів з їх природних сумішей.
Використання соляної кислоти занадто широке, щоб перерахувати окремо, але виділяються наступні галузі: Основним промисловим застосуванням є видалення поверхневої окалини із заліза або сталі («травлення») перед тим, як вона буде оброблена в листи або інші форми, або оцинкована або покрита. Виробництво хлорованих органічних хімічних речовин, зокрема вінілхлориду, поліуретанів та інших будівельних полімерів, споживає величезну кількість HCl. Кислота широко використовується для контролю р. Н води, включаючи нейтралізацію стічних потоків, і для регенерації іонообмінних пом'якшувачів води.
Застосування у побуті Хлороводень часто можна зустріти у складі різних засобів для чищення та дезинфекції. Його концентрація становить до 3%, що є цілком достатньо, але при роботі з ним потрібно обов'язково одягати захисні рукавички. Хлороводень може застосовуватися для виведення плям або усунення накипу. Речовину потрібно правильно зберігати у недоступних місцях. Використання у будівництві У багатьох будівельних процесах використання соляної кислоти є незамінним. Наприклад, її використовують у бетонній суміші, щоб зробити суміш більш морозостійкою. Використовувати речовину потрібно в правильній концентрації, щоб досягти потрібного результату.
У харчовій промисловості зареєстрована як регулятор кислотності (харчова добавка E507). Застосовується для виготовлення сельтерської води. Природна складова частина шлункового соку людини. У концентрації 0,3-0,5%, зазвичай у суміші з ферментом пепсином, призначається внутрішньо при недостатній кислотності. Щодня наш шлунок змушений оновлювати свою поверхню, яка постраждала внаслідок дії на нього шлункового соку. Середовище у вашому шлунку настільки агресивне, що якщо помістити в нього лезо для гоління, то воно повністю розчиниться через тиждень.
Цікаві факти про кислоти. Ортофосфорна кислота є важливою складовою Кока Коли. За своєю сферою застосування, ортофосфорна кислота просто унікальна. Її використовують повсюдно, починаючи від харчової промисловості та закінчуючи виробництвом добрив. Показник кислотності всіма улюбленої Кока Коли становить р. Н=2.8, тому опустивши в склянку з напоєм ювелірну прикрасу, можна позбутися нальоту та забруднень.
У теплокровних тварин в процесі обміну речовин виробляється невелика кількість молочної кислоти, і її запах дозволяє комарам і іншим кровососучим комахам знаходити свої жертви. Мурахи вміють виділяти їдку кислоту, яка служить відразу двом цілям - захист власного гнізда і попередження родичів. Тому її і назвали мурашиної.
Кислотність вимірюється за 14-бальною шкалою. Нейтральна відмітка відповідає дистильованій воді - 7. Цифри більше 7 свідчать про кислотність середовища, а нижче - про його лужність. У 1778 році французький хімік Антуан Лавуазьє припустив, що кислотні властивості обумовлені наявністю в їх складі кисню. Ця гіпотеза виявилася неспроможною, оскільки багато кислот не мають у своєму складі кисню, у той час як багато кисневмісних сполук не проявляють кислотних властивостей. Тим не менш, саме ця гіпотеза дала назву кисню як хімічного елемента. І тільки в 1833 році німецький хімік Юстус Лібіх визначив кислоту, як гідрогенвмісну сполуку, в якій водень може бути заміщений на метал.
Фторидна або плавикова кислота – це розчин фтороводню у воді. Назва «плавикова» походить від назви мінералу – плавикового шпату (Са. F2), з якого отримують фтороводень. Властивості плавикової кислоти багато в чому відрізняються від властивостей інших кислот. Унікальною особливістю плавикової кислоти є здатність розчиняти скло. Тому плавикову кислоту зберігають не в скляному посуді, а в посуді з пластику або в скляному посуді, покритому шаром парафіну.


про публікацію авторської розробки
Додати розробку