Презентація до курсу "Хімія у побуті" "Основи"





![Добування основ1. Взаємодія активних(лужних або лужноземельних) металів з водою:2 Na + 2 H2 O = 2 Na. OH + H2↑Ba + 2 H2 O = Ba(OH)2 + H2↑2. Електроліз водних розчинів деяких солей:2 Na. Cl + 2 H2 O = H2↑ + Cl2↑ + 2 Na. OH3. Взаємодія основних оксидів з водою: Ca. O + H2 O = Ca(OH)2 Na2 O + H2 O = 2 Na. OH4. Взаємодія розчинних солей з лугами(метод отримання нерозчинних основ): Cu. SO4 + 2 Na. OH = Cu(OH)2↓ + Na2 SO4 Fe. Cl3 + 3 Na. OH = 3 Na. Cl + Fe(OH)3↓5. Взаємодія солей з кислотами: Na[Al(OH)4] + HCl = Na. Cl + Al(OH)3↓ Добування основ1. Взаємодія активних(лужних або лужноземельних) металів з водою:2 Na + 2 H2 O = 2 Na. OH + H2↑Ba + 2 H2 O = Ba(OH)2 + H2↑2. Електроліз водних розчинів деяких солей:2 Na. Cl + 2 H2 O = H2↑ + Cl2↑ + 2 Na. OH3. Взаємодія основних оксидів з водою: Ca. O + H2 O = Ca(OH)2 Na2 O + H2 O = 2 Na. OH4. Взаємодія розчинних солей з лугами(метод отримання нерозчинних основ): Cu. SO4 + 2 Na. OH = Cu(OH)2↓ + Na2 SO4 Fe. Cl3 + 3 Na. OH = 3 Na. Cl + Fe(OH)3↓5. Взаємодія солей з кислотами: Na[Al(OH)4] + HCl = Na. Cl + Al(OH)3↓](/uploads/files/5008465/432282/487814_images/9.jpg)







![ІІІ. Амфотерні гідроксиди: Характерною для амфотерних гідроксидів є взаємодія як із кислотами, так і з основами: Zn(OH)2 + 2 HCl → Zn. Cl2 + 2 H2 OZn(OH)2 + 2 Na. OH → Na2 Zn. O2 + 2 H2 OAl(OH)3 + 3 Na. OH → Na3[Al(OH)6] ІІІ. Амфотерні гідроксиди: Характерною для амфотерних гідроксидів є взаємодія як із кислотами, так і з основами: Zn(OH)2 + 2 HCl → Zn. Cl2 + 2 H2 OZn(OH)2 + 2 Na. OH → Na2 Zn. O2 + 2 H2 OAl(OH)3 + 3 Na. OH → Na3[Al(OH)6]](/uploads/files/5008465/432282/487814_images/17.jpg)

































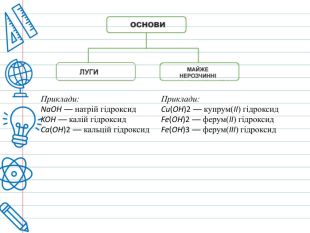
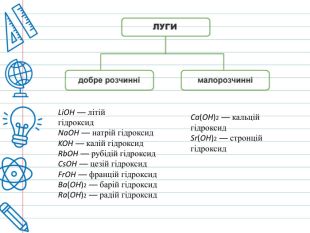
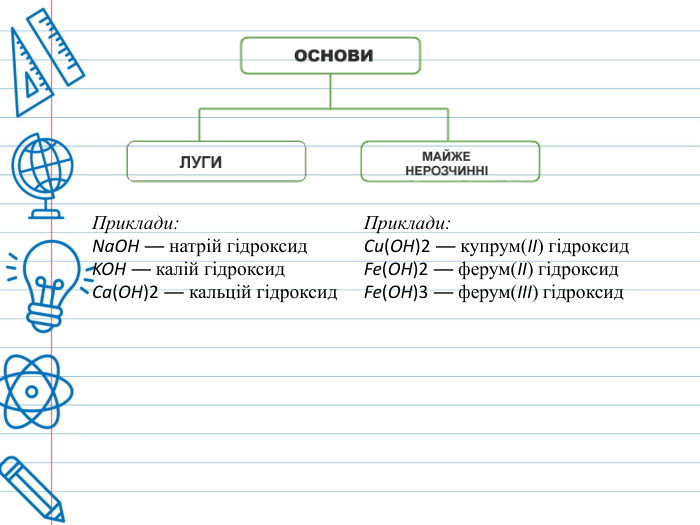
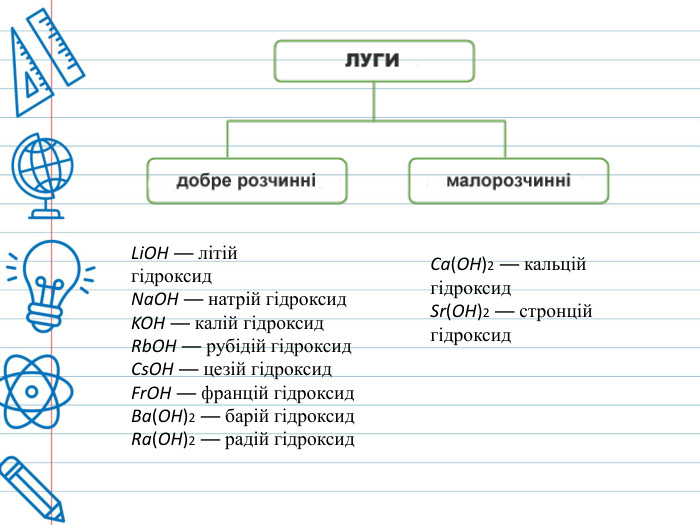
Класифікація основ. Основи класифікують за двома ознаками — розчинністю у воді, і кількістю гідроксильних груп. За розчинністю у воді ці сполуки ділять на дві групи: луги і практично нерозчинні основи . У свою чергу, луги ділять на добре розчинні у воді і малорозчинні (Са(ОН)2, Sr(OH)2). Нерозчинні основи поділяються на амфотерні гідроксиди (Al(OH)3, Be(OH)2, Zn(OH)2, Fe(OH)3) та власне нерозчинні основи. В залежності від кількості гідроксильних груп у складі молекули основи, їх класифікують на однокислотні (Na. OH), двокислотні (Ca(OH)2), трикислотні (Fe(OH)3), чотирикислотні(Ti(OH)4).
Фізичні властивості основ. При нормальних умовах основи (гідроксиди металів) є твердими кристалічними речовинами. Вони нелеткі і не мають запаху. Основи є речовинами йонної будови, тому вони повинні мати високу температуру плавлення, але при помірному нагріванні майже всі основи розкладаються на відповідний оксид і воду. Розплавити можна лише гідроксиди натрію і калію. Більшість основ не розчиняються у воді. Малорозчинними є гідроксиди малоактивних металічних елементів, а добре розчинні гідроксиди лужних елементів і сполуки барію.
Добування основ1. Взаємодія активних(лужних або лужноземельних) металів з водою:2 Na + 2 H2 O = 2 Na. OH + H2↑Ba + 2 H2 O = Ba(OH)2 + H2↑2. Електроліз водних розчинів деяких солей:2 Na. Cl + 2 H2 O = H2↑ + Cl2↑ + 2 Na. OH3. Взаємодія основних оксидів з водою: Ca. O + H2 O = Ca(OH)2 Na2 O + H2 O = 2 Na. OH4. Взаємодія розчинних солей з лугами(метод отримання нерозчинних основ): Cu. SO4 + 2 Na. OH = Cu(OH)2↓ + Na2 SO4 Fe. Cl3 + 3 Na. OH = 3 Na. Cl + Fe(OH)3↓5. Взаємодія солей з кислотами: Na[Al(OH)4] + HCl = Na. Cl + Al(OH)3↓
2. Взаємодіють з кислотними оксидами: Ca(OH)2 + CO2 = Ca. CO3↓ + H2 OЗаливка бетону і робота з ним є брудними роботами. В процесі утворюється багато стічних вод з лужним р. Н. Часто нормативні акти вимагають, щоб ці стічні води були очищені на ділянці. Одним з практичних способів нейтралізації основного р. Н є додавання CO2 у воду. Вуглекислий газ утворює слабку кислоту (вугільну кислоту. H2 CO3) в розчині, яка служить для зведення лужного р. Н до чогось ближче до нейтрального.
Великий обсяг сучасних досліджень передбачає розробку біодизельного палива. Часто цей матеріал можна виготовити з відпрацьованих рослинних масел. Рослинна олія обробляється лугом для створення біопалива. У маслах є змінна кількість кислоти, яку потрібно визначити, щоб працівники знали, скільки лугу потрібно додати, щоб зробити кінцеве паливо. Перед додаванням лугу нативне рослинне масло титрують, щоб дізнатися, скільки вільної кислоти присутня. Потім кількість доданого лугу можна регулювати з урахуванням кількості, необхідної для нейтралізації цих вільних кислот.
Кальцій гідроксид Технічна назва кальцій гідроксиду — гашене вапно або пушонка. Суспензію кальцій гідроксиду у воді називають вапняним молоком, а прозорий розчин цієї речовини носить назву — вапняна вода. Гашене вапно з давніх часів використовували в будівництві для приготування скріплюючої суміші — вапняного розчину. При змішуванні гашеного вапна, піску і води утворюється повільно застигаюча маса, яку в даний час (з деякими добавками) використовують для оштукатурювання стін. При застиганні вапняного розчину кальцій гідроксид (луг) взаємодіє з вуглекислим газом (кислотним оксидом), що міститься у повітрі, в результаті чого утворюється тверда маса (штучний камінь): Ca(OH)2+CO2→Ca. CO3↓+H2 O.
Вапняне молоко використовують у виробництві цукру, при виготовленні сумішей для побілки дерев і боротьби з хворобами рослин. Вапняну воду використовують у лабораторній практиці для виявлення вуглекислого газу. «Вапняну воду» застосовують у медицині проти опіків або як протиотруту при отруєннях сульфатною чи оксалатною кислотами.
Натрій гідроксид Інші назви цієї речовини: їдкий натр, їдкий натрій, каустична сода. Натрій гідроксид використовують як у промисловості, так і для побутових потреб. Каустик використовують при виробництві целюлози, миючих засобів (мила, шампунів, тощо), у нафтопереробці, при виробництві біодизельного палива, для нейтралізації кислот. У побуті натрій гідроксид використовують як основу деяких засобів для ліквідації засмічень каналізаційних труб. Засоби для очищення каналізаційних труб від відкладень жиру можуть містити більше 40 % натрій гідроксиду.
Гідроксид натрію - універсальна хімічна речовина. Його можна використовувати для таких приземлених цілей, як очищення засмічених стоків. Кілька комерційних препаратів містять для цієї мети гідроксид натрію. Він також має ряд застосувань у галузі харчової промисловості. Морозиво загущають за допомогою. Na. OH. Якщо оливки замочити в розчині, що містить гідроксид натрію та інші хімічні речовини, оливки почорніють. М'які кренделі роблять жувальними шляхом нанесення на їжу гідроксиду натрію. Ця сполука широко використовується в синтезі пластмас, для травлення алюмінію, для видалення фарби, і використовується в дерогації великої рогатої худоби. Гідроксид натрію - дуже їдка речовина, також відома як луг. Луг є інгредієнтом при виготовленні мила. Необхідно дотримуватися обережності з міцними основами, такими як гідроксид натрію, так як вплив може призвести до сильних опіків.
Виробництво мила та миючих засобів: Подібно до гідроксиду натрію, гідроксид калію використовується в процесі омилення для виробництва мила. Реагує з жирами та оліями з утворенням калієвих солей жирних кислот (мила). Гідроксид калію також використовується в деяких складах рідкого мила.
Гідроксид амонію NH4 OH – один з найважливіших хімічних реактивів, розбавлений розчин якого «нашатирний спирт» застосовують як слабку основу в хімічній практиці, у медицині, домашньому господарстві Гідроксид амонію, який часто записують як NH₄OH, являє собою розчин аміаку (NH₃) у воді. Його зазвичай називають розчином аміаку або водним розчином аміаку.
Вся складна електроніка і апарати в космічному кораблі генерують тепло, як і космонавти. Кораблі мають складне розташування систем для розсіювання цього тепла в космічний простір. Однією зі складових цієї системи є серія змійовиків, наповнених аміаком, які розташовані на зовнішній стороні човника. Аміак поглинає тепло, а потім випускає його в космос, коли газ циркулює через котушки. Такий підхід є одночасно недорогим і ефективним.
Чистячі та побутові засоби: Гідроксид амонію використовується в різних миючих засобах, таких як миючі засоби для скла та підлоги, завдяки своїй здатності прорізати жир і бруд. Він також міститься в деяких побутових розчинах аміаку, які використовуються для загального прибирання. Регулювання p. H під час обробки води: У процесах очищення води гідроксид амонію використовується для регулювання p. H води. Він може діяти як нейтралізатор кислої води та запобігати корозії в системах розподілу води.
Харчова промисловість: Гідроксид амонію використовується в харчовій промисловості як антимікробний засіб для деяких м'ясних продуктів. Він використовується для зменшення бактеріального забруднення та підвищення безпеки обробленого м’яса. Розпушувач у випічці: У деяких процесах випікання гідроксид амонію використовується як розпушувач. Це сприяє зростанню певної випічки, наприклад печива та крекерів.
Антациди в медицині: Гідроксид магнію зазвичай використовується як антацид для нейтралізації надлишку шлункової кислоти. Він діє шляхом реакції з соляною кислотою в шлунку з утворенням хлориду магнію та води. Це допомагає полегшити симптоми розладу травлення, печії та кислотного рефлюксу.
Антипірен: Гідроксид магнію використовується як антипірен в різних сферах застосування. Під впливом тепла він виділяє водяну пару і поглинає значну кількість енергії, знижуючи горючість матеріалів. Він використовується в пластмасах, гумі та інших матеріалах для підвищення вогнестійкості.
Контроль запаху: Гідроксид магнію іноді використовується для контролю запаху на промислових і міських очисних спорудах. Він може нейтралізувати кислі та неприємні сполуки. Поживні добавки в корм для худоби: Гідроксид магнію іноді додають у корм худобі як добавку магнію. Це допомагає запобігти таким захворюванням, як трав'яна тетанія у тварин.
Ізоляція кабелю: У кабельній промисловості гідроксид магнію використовується як вогнезахисний та димогасний засіб для ізоляції кабелів. Електроніка та батареї: Гідроксид магнію використовується у виробництві деяких електронних компонентів і акумуляторів. Він може використовуватися у виробництві оксиду магнію, основного матеріалу в певних технологіях акумуляторів.
Бджоли - прекрасні істоти, які допомагають рослинам процвітати. Вони переносять пилок з однієї рослини на іншу, щоб полегшити ріст і розвиток рослин. Однак вони можуть дуже боляче жалити! Для тих, хто страждає алергією на бджолину отруту, це може бути серйозною, небезпечною для життя проблемою. Для всіх інших людей це може бути болючим досвідом. При укусі бджоли надання першої допомоги полягає в нанесенні на укушену область пасти харчової соди (бікарбонату натрію). Ця речовина дає слабколужну реакцію та допомагає при свербінні і набряку, які супроводжують укус бджоли.
Зверни увагу!Всі роботи з лугами слід проводити в окулярах, користуючись гумовими рукавичками. Якщо ж луг усе-таки потрапив на поверхню тіла, уражене місце потрібно добре прополоскати струменем проточної води. Якщо луг потрапив в око — безперервно промивати проточною водою не менше 35-40 хвилин, і звернутися за медичною допомогою.


про публікацію авторської розробки
Додати розробку