Презентація до уроку для 11 класу з хімії на тему: "Амоніак. Нітратна кислота"






















Мета уроку. Мета: сформувати в учнів знання про амоніак (аміак) та нітратну кислоту; дати уявлення про електролітичну дисоціацію амоніаку та нітратної кислоти; про взаємодію з кислотами, горіння амоніаку; реакції обміну; взаємодію з металами нітратної кислоти; визначити сфери застосування амоніаку та нітратної кислоти; поширеність у природі завдання. Завдання: навчальні: ознайомитися з фізичними і хімічними властивості амоніаку та нітратної кислоти; дати уявлення про електролітичну дисоціацію амоніаку та нітратної кислоти; про взаємодію з кислотами, горіння амоніаку; реакції обміну; взаємодію з металами нітратної кислоти; визначити сфери застосування амоніаку та нітратної кислоти; поширеність у природі виховні: формування і розвиток мотивації до навчання шляхом реалізації потенційних інтелектуальних, можливостей; розвивальні: розвивати вміння й навички учнів працювати з інтерактивним матеріалом, логічно мислити, спостерігати, робити висновки та узагальнення
Основні поняття й терміни: Основні поняття й терміни: амоніак, нітратна кислота, хімічні реакціїОбладнання та матеріали: Обладнання та матеріали: 3 Д молекули амоніаку, нітратної кислоти, схеми хімічних реакцій, інтерактивний матеріал, використання додатку Ar. Book. Методи проведення: Методи проведення: лекція, розповідь, пояснення, бесіди, ілюстрації, демонстрації Тип уроку: Тип уроку: засвоєння нових знань
ПЛАН УРОКУI. Організаційний етап ……………………………………………………………3 хв. II. Мотивація навчальної діяльності……………………………………………..2 хв. III. Стимулювання навчальної діяльності ………………………………………2 хв. IV. Актуалізація опорних знань………………………………………………… 2 хв. V. Пояснення нового матеріалу……………………………………………......25 хв. VI. Закріплення нового матеріалу……………………………………………….5 хв. VII. Підбиття підсумків уроку та повідомлення домашнього завдання.…6 хв.
Хід уроку. Організаційний етап.«Успішні та неуспішні люди не надто відрізняються своїми здібностями. Вони відрізняються лише своїм бажанням досягти максимуму свого потенціалу» (Джон Максвел). Я бажаю вам розпочати урок з гарним настроєм і отримати від нього задоволення і гарні результатимобілізація уваги учнів, психологічна підготовка та налаштування до навчальної діяльності. Мотивація навчальної діяльності. Бесіда та обговорення з учнями теми уроку. Приклади застосування амоніаку та нітратної кислоти. Учні обговорюють власний досвід та демонструють знання з теми накопичений за період навчання. Проблемне питання уроку- на основі теоретичних знань зробити висновки про накопичення в овочах і фруктах нітратів та їх шкідливість для здоров’я людини
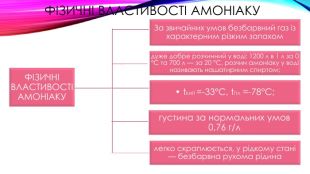
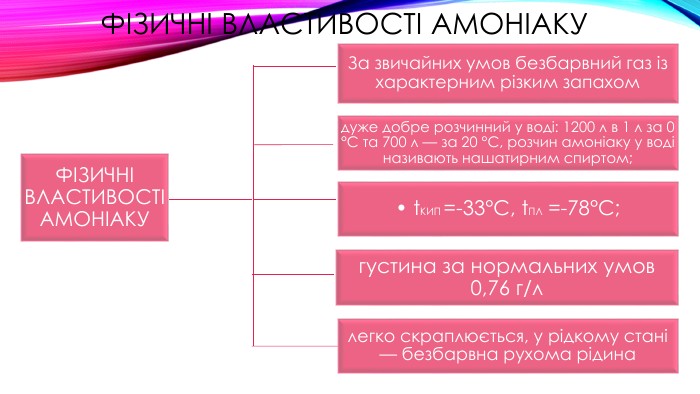
Фізичні властивості амоніаку. ФІЗИЧНІ ВЛАСТИВОСТІ АМОНІАКУдуже добре розчинний у воді: 1200 л в 1 л за 0 °С та 700 л — за 20 °С, розчин амоніаку у воді називають нашатирним спиртом;• t. КИП =-33°С, t. ПЛ =-78°С; густина за нормальних умов 0,76 г/ллегко скраплюється, у рідкому стані — безбарвна рухома рідина. За звичайних умов безбарвний газ із характерним різким запахом
Стимулювання навчальної діяльності. Зазвичай Нобелівську премію присуджують за відкриття та дослідження певних речовин або класів сполук, ефектів, теорій тощо. Амоніак є винятком. Фіксація атмосферного азоту є настільки важливою для людства, що за роботи з амоніаком Нобелівську премію отримали в різні роки аж п’ять хіміків: В. Оствальд (1909 р.) — за дослідження технології каталітичного окиснення амоніаку, Ф. Габер (1918 р.) — за синтез амоніаку зі складових його елементів, К. Бош і Ф. Бергіус (1931 р.) — за втілення у промисловість технології синтезу амоніаку з простих речовин, Г. Ертль (2007 р.) — за дослідження молекулярного механізму синтезу амоніаку на поверхні каталізатора. Насправді аміак (і його розчин) без запаху. Коли людина вдихає аміак відбувається помилка нюхового нерва: молекула аміаку близька до молекули води, тому божеволіє частка мозку, відповідальна за вологість і сухість. Це ми й сприймаємо як різкий запах.
У побуті та промисловості частіше використовують назву «аміак». Для речовини з такою невеликою молярною масою амоніак має досить високу температуру кипіння (порівняйте: t кип (СН4)=-162°С). Це пояснюється можливістю утворення водневих зв’язків між молекулами амоніаку Молекули амоніаку також утворюють водневі зв’язки з молекулами води, що пояснює добру розчинність амоніаку у воді. Амоніак є рекордсменом серед газів за розчинністю у воді.
хімічні властивості амоніаку. Кислотно-основні властивості амоніаку зумовлені можливістю його молекул утворювати четвертий зв’язок за донорно-акцепторним механізмом. Наприклад, із йонами Гідрогену амоніак утворює йон амонію: Електролітична дисоціація. Розчин амоніаку у воді виявляє основні властивості. Він змінює забарвлення індикаторів, що свідчить про наявність у ньому гідроксид-іонів ОН . У розчині молекули амоніаку утворюють із молекулами води гідрат NH3 ∙ H20 (саме так його потрібно записувати), який піддається електролітичній дисоціації:Із поширених неорганічних сполук амоніак — єдина речовина, що виявляє основні властивості й не є гідроксидом металічного елемента
хімічні властивості амоніаку Взаємодія з кислотами. Основні властивості амоніаку виявляються в реакціях із кислотами. У цих реакціях утворюються солі амонію: Оскільки амоніак — слабка основа, то солі, утворені амоніаком і слабкими кислотами, піддаються гідролізу. Тому амоніак взаємодіє із сильними кислотами, кислотами середньої сили та не дуже слабкими (метанова, етанова, сульфітна тощо). Зі слабкими багатоосновними кислотами (карбонатна, ортофосфатна, сульфідна) він утворює лише кислі солі
хімічні властивості амоніаку. Горіння амоніаку. Амоніак є відновником. Він горить у чистому кисні або у збагаченому киснем повітрі блідо-жовтим полум’ям з утворенням азоту і води. Горіння амоніаку у збагаченому киснем повітрі Окиснення амоніаку за наявності каталізатора. Окиснення амоніаку з каталізатором — промислово важлива стадія процесу фіксації атмосферного азоту і нітрифікації ґрунтів
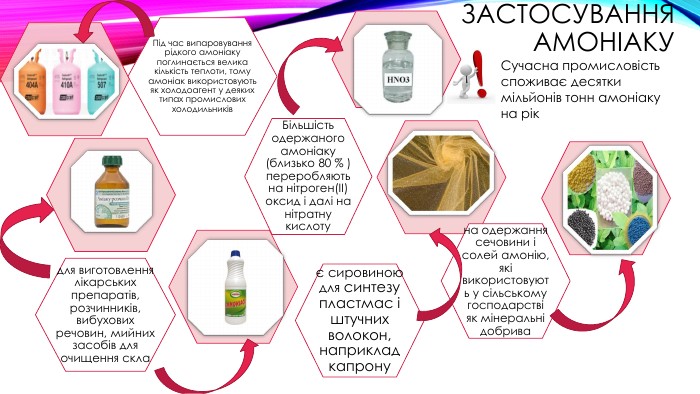
Застосування амоніаку. Сучасна промисловість споживає десятки мільйонів тонн амоніаку на рікє сировиною для синтезу пластмас і штучних волокон, наприклад капронуна одержання сечовини і солей амонію, які використовують у сільському господарстві як мінеральні добрива. Більшість одержаного амоніаку (близько 80 % ) переробляють на нітроген(ІІ) оксид і далі на нітратну кислотудля виготовлення лікарських препаратів, розчинників, вибухових речовин, мийних засобів для очищення скла. Під час випаровування рідкого амоніаку поглинається велика кількість теплоти, тому амоніак використовують як холодоагент у деяких типах промислових холодильників
Поширеність у природі та біологічне значення аміаку. Аміак є кінцевим продуктом азотистого обміну в організмі людини і тварин. Він утворюється при метаболізмі білків, амінокислот і інших азотистих сполук. Він високо токсичний для організму, тому більша частина аміаку в ході орнітінового циклу конвертується печінкою в більш нешкідливе і менш токсичну сполуку – карбамід (сечовину). Сечовина потім виводиться нирками, причому частина сечовини може бути конвертована печінкою або нирками назад в аміак. Аміак може також використовуватися печінкою для зворотного процесу – ресинтеза амінокислот з аміаку і кетоаналогов амінокислот. Цей процес носить назву «відновне амінування». Таким чином з щавелевоуксусной кислоти виходить аспарагінова, з α -кетоглутаровой – глутамінова і т. д.
Історична довідка. АДАДУ́РОВ Іван Євграфович(19. 12. 1879, м. Сновськ, нині Щорс Черніг. обл. – 26. 08. 1938, Харків) – хімік. Д-р тех. н., проф. Закін. Варшав. політех. ін-т. До 1928 – на інж. та адм. роботі на хім. підпр-вах України; 1928–33 – зав. каф. основної хім. технології Одес. хім.-технол. ін-ту; 1933–38 – зав. каф. технології неорган. речовин Харків. хім.-технол. ін-ту. Наук. праці в галузі теорії і практики каталізу та кінетики, основ хім. технологій. Удосконалив технології вироб-ва сірч. і азот. кислот та різних солей, а також технології приготування каталізаторів для процесів окислення оксиду сірки й аміаку. Розробив новий метод одержання сірч. кислоти методом контакт. окислення вологого оксиду сірки, який одержували, окислюючи сірководень. Уперше одержав ціанистий водень шляхом окислення суміші аміаку і метану та дослідив хім.-фіз. умови вироб-ва синильної кислоти.
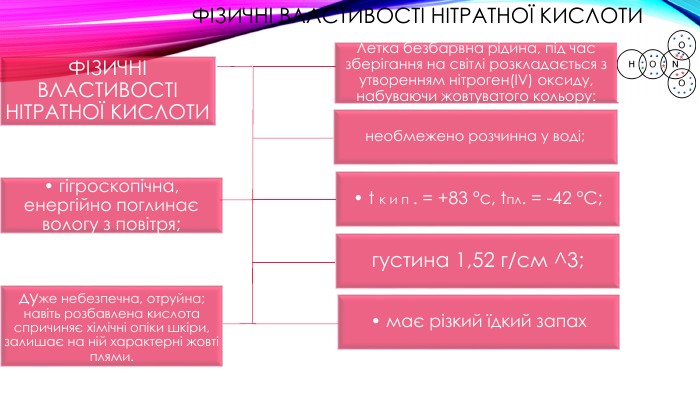
Фізичні властивості НІТРАТНОЇ КИСЛОТИФІЗИЧНІ ВЛАСТИВОСТІ НІТРАТНОЇ КИСЛОТИнеобмежено розчинна у воді;• t к и п . = +83 °с, tпл. = -42 °С; густина 1,52 г/см ^3;• має різкий їдкий запах. Летка безбарвна рідина, під час зберігання на світлі розкладається з утворенням нітроген(ІV) оксиду, набуваючи жовтуватого кольору:• гігроскопічна, енергійно поглинає вологу з повітря;дуже небезпечна, отруйна; навіть розбавлена кислота спричиняє хімічні опіки шкіри, залишає на ній характерні жовті плями.
хімічні властивості нітратної кислоти Електролітична дисоціація. Нітратна кислота — сильний електроліт. Вона змінює забарвлення індикаторів, у розбавлених розчинах повністю дисоціює на йони: Реакції обміну. Нітратна кислота виявляє всі загальні властивості кислот, тобто взаємодіє з:• основними оксидами:• амфотерними оксидами та гідроксидами:• основами:•солями слабких кислот:
Взаємодія з металами. Як і сульфатна, нітратна кислота є сильним окисником: по-перше, через наявність у розчинах йонів Гідрогену Н+, по-друге, через сильніший окисник нітрат-іон NО3-. Це зумовлює особливості її взаємодії з металами. Нітратна кислота взаємодіє майже з усіма металами за винятком золота, платини й деяких інших. У більшості випадків окрім солей утворюються різні продукти відновлення нітрат-іонів . Це залежить від концентрації кислоти та активності металу: чим активніший метал і менша концентрація кислоти, тим сильніше відбувається відновлення.
Активніші метали можуть відновити нітратну кислоту до нітроген(І) оксиду, азоту N2 або навіть до амоніаку: Залізо, хром і алюміній на холоді з концентрованою нітратною кислотою не взаємодіють унаслідок утворення на їхній поверхні тонкого шару хімічно стійкого оксиду. Про цей процес говорять, що нітратна кислота пасивує ці метали. Завдяки цьому концентровану нітратну кислоту можна перевозити у сталевих цистернах. У реакціях нітратної кислоти з металами ніколи не утворюється водень. Концентрована нітратна кислота пасивує залізо і алюміній.
Актуалізація опорних знань. Щоб наша робота була продуктивною та ефективною дайте відповіді на поставлені запитання: Порівняйте фізичні й хімічні властивості аміаку та нітратної кислоти. Порівняйте хімічні властивості нітратної та сульфатної кислот. Як залежать продукти взаємодії нітратної кислоти з металами від активності металів і концентрації кислоти?Схарактеризуйте застосування нітратної кислоти
Вплив нітратів на здоров’я людинипроблема накопичення в овочах і фруктах нітратів. Перш за все хотілося б відзначити, що азот поряд з фосфором, калієм, і іншими незамінними елементами становить основу живлення рослин. Без азоту неможливий синтез білків, а, отже, і життя. Поглинається він лише у вигляді легкорозчинних азотистих і аміачних солей, якими є нітрати. В рослинах нітрати перетворюються в білкові та інші органічні сполуки, проходячи проміжні стадії відновлення до нітратів і аміаку. Так що наявність нітратів - явище закономірне. Нітрати в основному накопичуються в коренях, коренеплодах, стеблах, черешках і великих жилках листя, значно менше в їх плодах. Нітратів більше в зелених плодах, ніж у стиглих. У сільськогосподарських рослинах найбільше нітратів міститься в салаті (особливо тепличному), в редьці, петрушці, редисці, столовому буряку, капусті, моркві, кропі: в буряках і моркви більше нітратів у верхній частині коренеплоду, а в моркві також і в серцевині його, в капусті - в качані, в товстих черешках листя і у верхніх листках. З'ясовано також, що у всіх овочів і плодів найбільше міститься нітратів в їх шкірці. При невеликому споживанні нітратів з їжею, вони не накопичуються, легко і швидко виводяться з організму, але якщо їх багато, то:1. Нітрати під впливом ферменту нітратредуктази відновлюються до нітритів, які взаємодіють з гемоглобіном крові і окислюють в ньому 2-х валентний залізо в 3-х валентний. В результаті утворюється речовина метгемоглобін, який вже не здатний переносити кисень. Тому порушується нормальне дихання клітин і тканин організму (тканинна гіпоксія), в результаті чого накопичується молочна кислота, холестерин, і різко падає кількість білка.2. Нітрати сприяють розвитку патогенної кишкової мікрофлори, яка виділяє в організм людини токсини, в результаті чого відбувається отруєння організму.
Вплив нітратів на здоров’я людини3. Нітрати знижують вміст вітамінів в їжі, які входять до складу багатьох ферментів, а через них впливають на всі види обміну речовин.4. При тривалому надходженні нітратів в організм людини зменшується кількість йоду, що призводить до збільшення щитовидної залози.5. Встановлено, що нітрати сильно впливають на виникнення ракових пухлин в шлунково-кишковому тракті у людини. Особливо чутливі до нітратів діти грудного віку та самого раннього віку. Для дорослої людини гранично допустима норма нітратів 5 мг на 1 кг маси тіла людини, тобто 0,25 г на людину вагою в 60 кг. Для дитини допустима норма не більше 50 мг. Основна маса нітратів потрапляє в організм людини з консервами і свіжими овочами (40-80% добової кількості нітратів). Незначна кількість надходить з хлібобулочними виробами і фруктами. Частина нітратів може утворюватися в самому організмі людини при його обміні речовин. Також нітрати можуть потрапляти в організм людини з водою, тваринною їжею: нітрати і нітрити додають в готову м'ясну продукцію з метою поліпшення споживчих властивостей і для більш тривалого її зберігання.
Закріплення нового матеріалу. Опрацювання актуальних питань до уроку. Зазвичай газуваті речовини, навіть полярні, погано розчиняються у воді. Ґрунтуючись на понятті про хімічну рівновагу та теорії електролітичної дисоціації, поясніть дуже велику розчинність гідроген хлориду та амоніаку у воді. Чи згодні ви з твердженням, що за обсягами виробленого амоніаку можна визначити роль економічний розвитку країни? Обґрунтуйте свою відповідь. Дослідіть властивості нашатирного спирту — 10%-го розчину амоніаку, який можна придбати в аптеці. Дотримуйтесь правил безпеки. Амоніак легко розпізнати за характерним запахом. Обережно відкрийте розчин. До невеликої кількості розчину амоніаку краплинами додавайте розчин лимонної кислоти, поки запах амоніаку не зникне. Як пояснити зникнення запаху? Якщо до отриманого розчину додати соду, запах амоніаку з’явиться знову. Чому?
повідомлення домашнього завдання.§ 24-25 ЗНАЙДІТЬ ДОДАТКОВУ ІНФОРМАЦІЮ В ІНТЕРНЕТІ та підготуйте коротке повідомлення, доповідь: Цікаві факти!! Пари нашатирного спирту здатні змінювати забарвлення квітів. Наприклад, блакитні та сині пелюстки стають зеленими, яскраво червоні – чорними. Хмари Юпітера складаються з аміаку. Деякі квіти, які не мають запаху від природи, після обробки аміаком починають пахнути. Наприклад, приємний аромат набувають айстри.


про публікацію авторської розробки
Додати розробку