Презентація до уроку хімії 11 класі з теми "Ковалентний хімічний зв’язок"
Про матеріал
Презентація до уроку хімії в 11 класі з теми " Ковалентний зв’язок: полярний, неполярний, механізми його появи."
Перегляд файлу
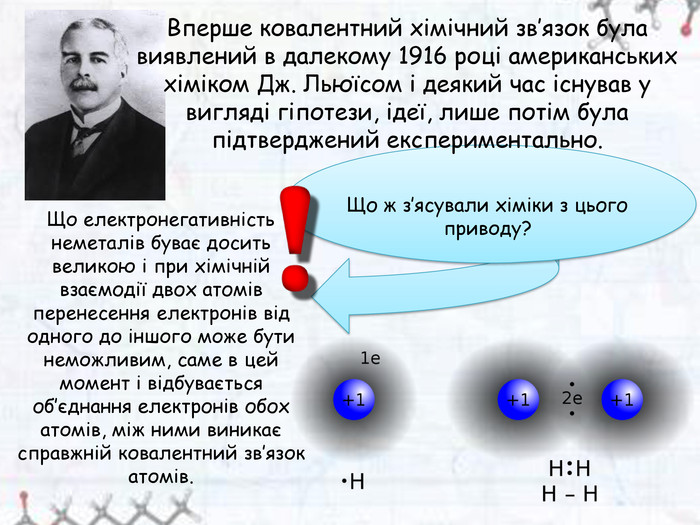
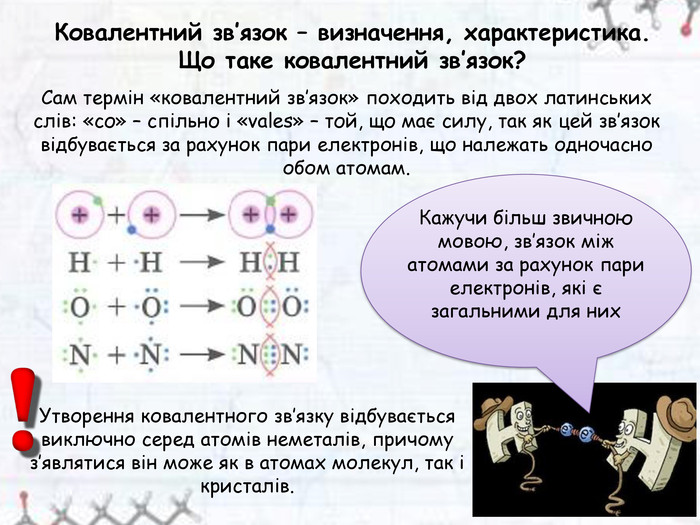
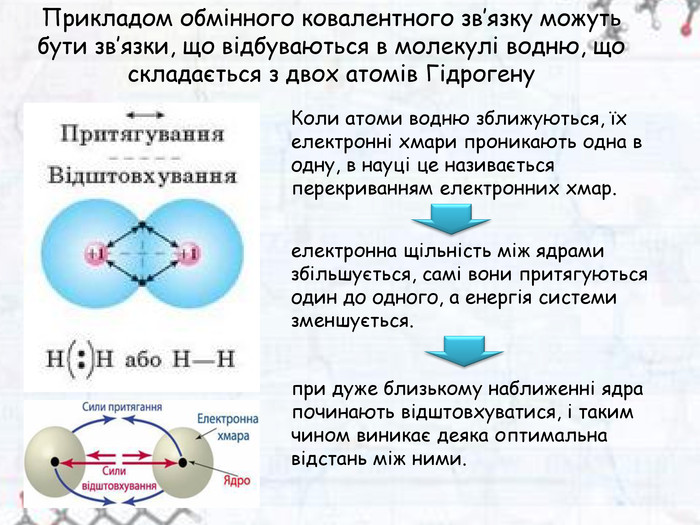
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку










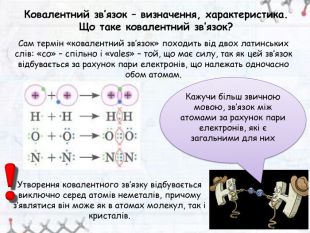

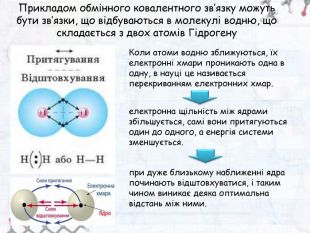
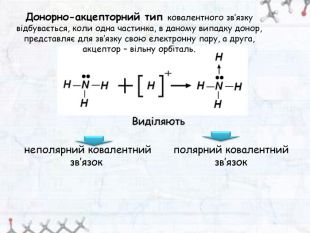

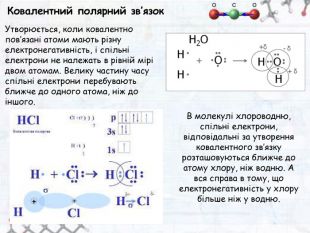



-

Переверзева Інна Євгенівна
07.10.2025 в 23:46
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ціпотан Людмила
25.09.2024 в 21:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дубко Тетяна Іванівна
11.10.2023 в 16:52
Дякую за чудову презентацію!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сулік Оксана Петрівна
25.09.2023 в 08:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Матвійчук Катерина Анатоліївна
05.10.2022 в 10:04
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Авер'янова Юлія Геннадіївна
03.10.2022 в 14:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дробот Олена Геннадіївна
02.10.2022 в 17:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Нейченко Світлана Павлівна
29.09.2022 в 22:43
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шаповал Зоя Миколаївна
27.09.2022 в 12:46
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Велика Наталія Миколаївна
24.09.2022 в 22:14
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гончар оксана
06.02.2022 в 15:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Обертінська Вікторія
27.09.2021 в 23:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 9 відгуків