Презентація до уроку хімії на тему "Гідроліз солей"
Про матеріал
Пропоную Вашій увазі методичну розробку уроку хімії по темі " Гідроліз солей" .Даний матеріал можна використовувати на уроках хімії .
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку









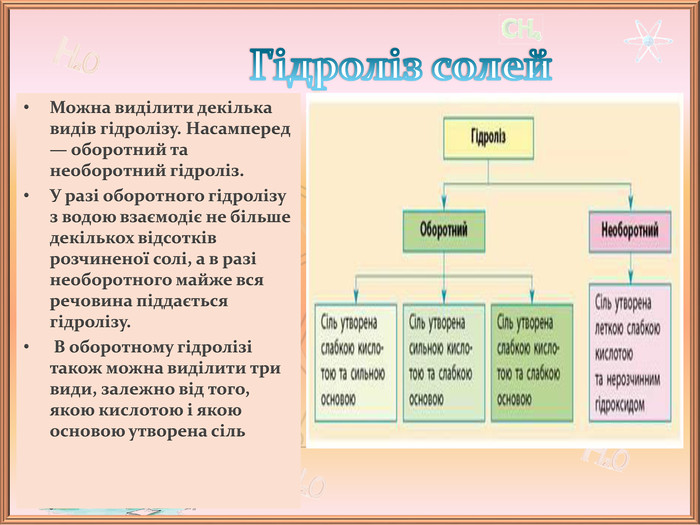
















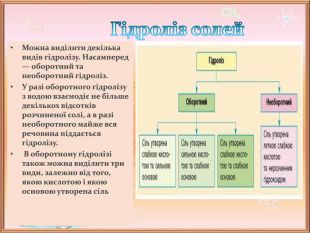








-

Бурда Тетяна Валеріївна
23.10.2022 в 22:46
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Гура Ірина Сергіївна
05.11.2021 в 07:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Чуб Світлана
04.11.2021 в 14:40
Презентація дуже неестетично оформлена, рясніє помилками на кшталт "гідролізуються утворюючі вільні гідроген-іони"
Загальна:
3.7
Структурованість
4.0
Оригінальність викладу
2.0
Відповідність темі
5.0
-

Шевченко Світлана Василівна
01.11.2021 в 10:59
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Стародуб Інна Анатоліївна
19.03.2020 в 20:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тимошенко Тамара Кіндратівна
12.12.2019 в 17:45
Дякую ! Дуже допомогло при проведенні уроку. В сільських школах бракує реактивів, тому можна ще підключити "Віртуальну лабораторію" або матеріали з неї.
Загальна:
4.7
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука