Презентація до уроку хімії у 8 класі "Хімічні властивості амфотерних гідроксидів"
Про матеріал
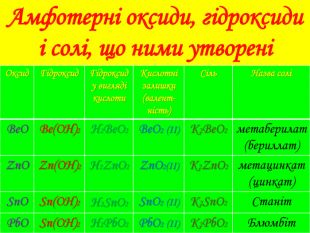
Презентацію до уроку хімії у 8 класі "Хімічні властивості амфотерних гідроксидів" можна використовувати на уроці, під час дистанційного навчання. Містить гіперпосилання на тести он-лайн та відеоуроки.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




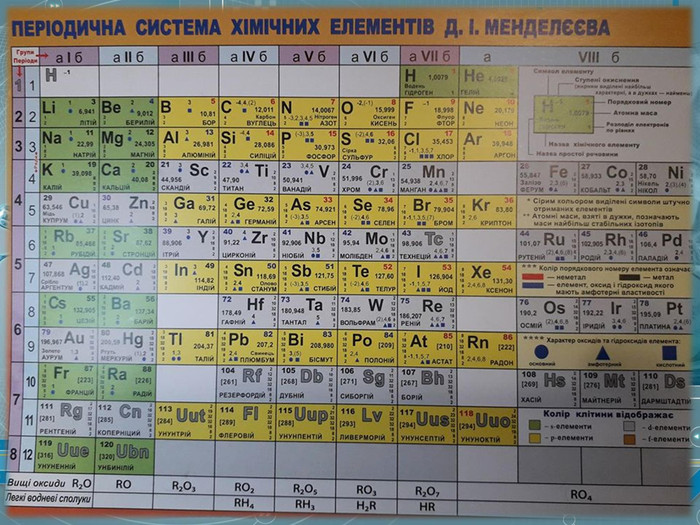
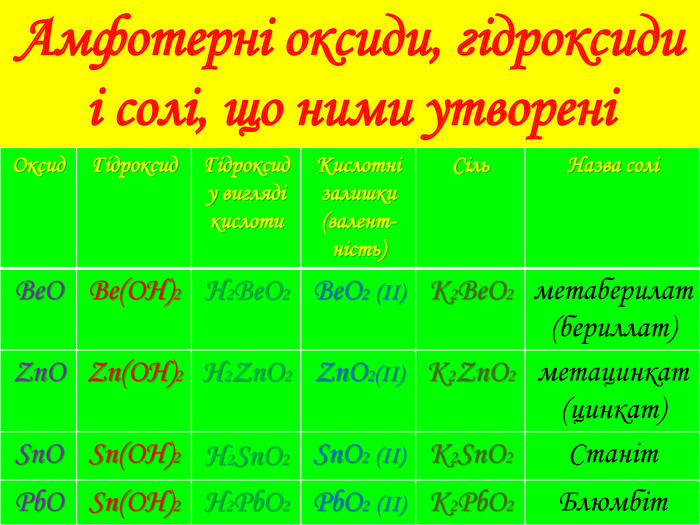
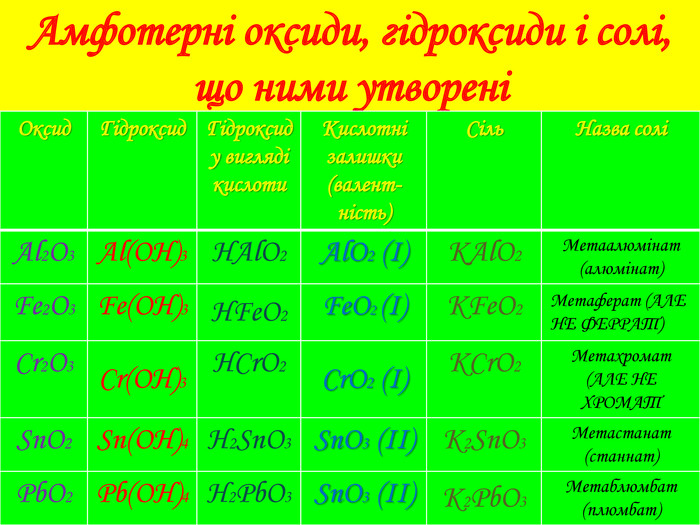




![Кислотні властивості амфотерних гідроксидів (в розчині)Амфотерні сполуки, взаємодіючи з основами, поводяться як кислоти і утворюють комплексні сполуки. Al(OH)3 + KOH → K[Al(OH)4]Al(OH)3 + 3 KOH → K3[Al(OH)6] Реакція відбувається в розчиніКалій тетра-гідроксоалюминат. Калій гекса-гидроксоалюминат Кислотні властивості амфотерних гідроксидів (в розчині)Амфотерні сполуки, взаємодіючи з основами, поводяться як кислоти і утворюють комплексні сполуки. Al(OH)3 + KOH → K[Al(OH)4]Al(OH)3 + 3 KOH → K3[Al(OH)6] Реакція відбувається в розчиніКалій тетра-гідроксоалюминат. Калій гекса-гидроксоалюминат](/uploads/files/155612/177553/190303_images/11.jpg)















-

Зінченко Наталія Миколаївна
11.03.2024 в 22:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Костіна Неля Миколаївна
09.04.2023 в 12:50
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мандзюк Лідія
28.03.2023 в 11:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Арсенюк Наталія
13.04.2022 в 22:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Михайленко Лідія
23.03.2022 в 07:51
Дякую за чудову подачу матеріалу.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Цвєткова Ірина Сергіївна
28.04.2021 в 17:32
Чудова презентація! Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

ПАрхоменко Олександр
22.03.2021 в 21:16
Дякую за чудову презентацію!
Особливий привіт з Інгульської школи))))
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Фертак Наталя Володимирівна
14.02.2021 в 21:12
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 5 відгуків