Презентація до уроку хімії в 11 класі "Явище періодичної зміни властивостей елементів і їхніх сполук на основі уявлень про електронну будову атомів"
Про матеріал
Презентація створена до 1го уроку хімії в 11 класі відповідно до нової програми Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку










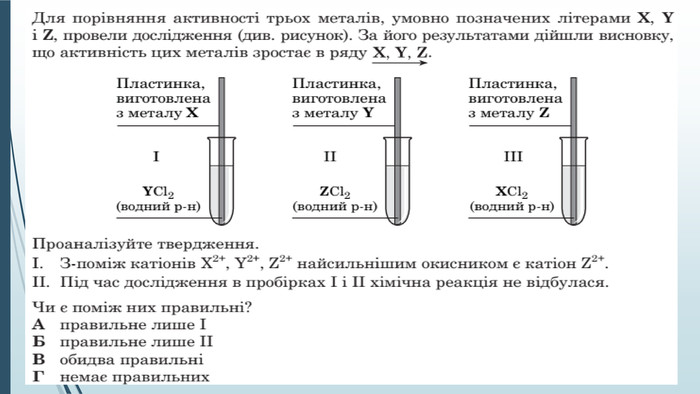
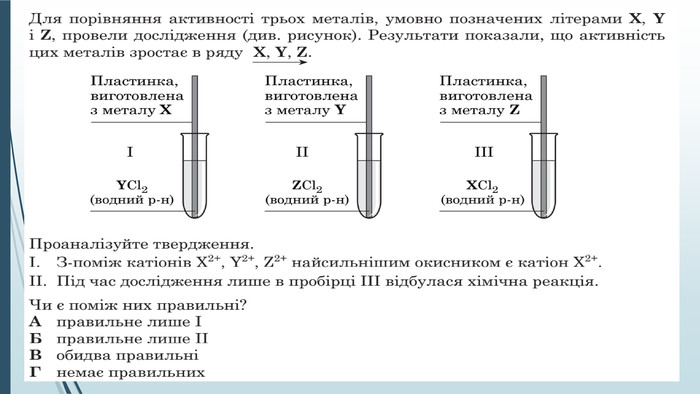





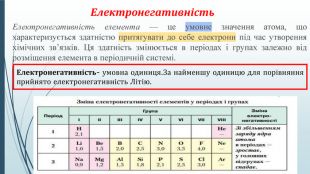
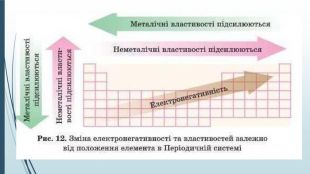




-

Лещенко Надія Павлівна
24.08.2021 в 13:10
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Новікова Тетяна Дмитрівна
08.04.2021 в 11:17
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Новікова Тетяна Дмитрівна
08.04.2021 в 11:17
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Заяць Євдокія Дмитрівна
09.09.2020 в 19:35
Дуже добре, що використані завдання ЗНО різних років. Дякую за розробку!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Куц Наталя Іванівна
04.09.2019 в 20:37
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука