Презентація до уроку хімії з теми "Йонний, металічний, водневий хімічні зв’язки".
Про матеріал
Презентація до уроку хімії в 11 класі з теми "Йонний, металічний, водневий хімічні зв’язки." Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку









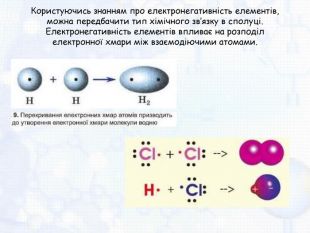

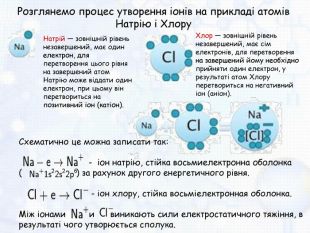
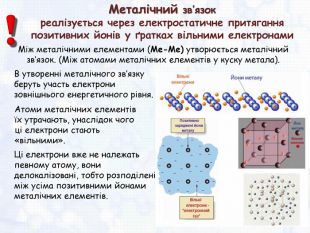
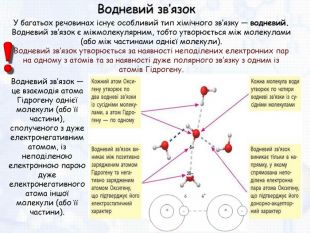
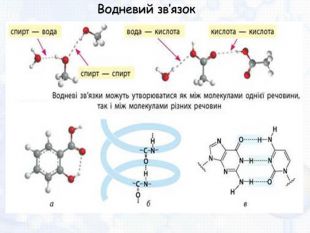

-

Бузницька Ольга Миколаївна
10.09.2023 в 14:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Грейцер Ірина Миколаївна
30.10.2022 в 19:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
02.10.2022 в 20:41
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Єгорова Тетяна Анатоліївна
26.09.2022 в 16:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Инна
22.09.2022 в 19:46
Чудова презентація.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Франчук Мар'яна Віталіївна
19.09.2022 в 23:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука