Презентація до уроку в 11 класі "Гальванічний елементяк джерело електричного струму "






























Відкриття А. Вольта.Італійський фізик Алессандро Вольта (1745 - 1827), вивчаючи досліди Гальвані, прийшов до іншого висновку. Причиною скорочення м’язів є не «тваринна електрика», а електричний струм, що виникає внаслідок дотику металу до вологого тіла м’язів жаби, яка лежить на металевій поверхні. Саме контакт двох різнорідних металів став своєрідним джерелом струму. Вольта сконструював перше хімічне джерело постійного електричного струму . Найпростіший гальванічний елемент — елемент Вольта — складається з двох металевих пластин, мідної та цинкової, опущених у водний розчин сульфатної кислоти (H2 SO4).
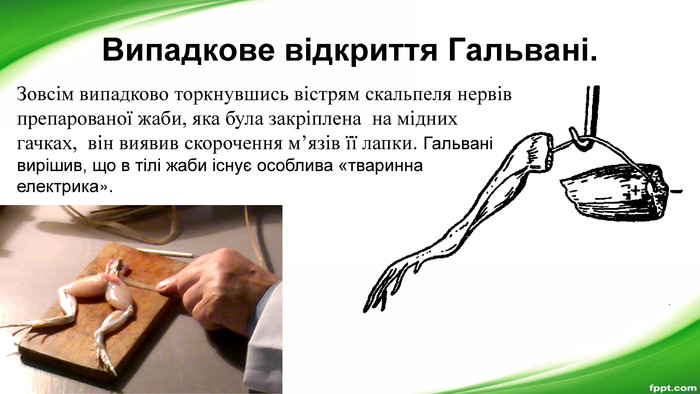
Перший гальванічний елемент. А. Вольта сконструював оригінальний пристрій, що виробляв електричний струм. Це був немов товстий «бутерброд» iз металічних пластин (міді і цинку) i тканини, яка заздалегідь була просякнута розчином сульфатної кислоти. До першої та останньої пластинок припаювали дротинки. Якщо ix занурювали у воду, то на поверхні кожної дротинки починалося виділення газу. Це відбувався електроліз води. Отже, крізь воду проходив електричний струм. Винайдене джерело струму було названо гальванічним елементом на честь Луїджі Гальвані (1737–1798) – італійського лікаря, анатома і фізіолога, який є одним із засновників електрофізіології.
Гальванічний елемент Даніеля-ЯкобіГальванічний елемент Даніеля-Якобі складається з двох посудин. В одній міститься розчин цинк сульфату, у який занурено пластинку з цинку, в іншій – купрум(ІІ) сульфату у який занурено пластинку з міді. Розчини з’єднано трубкою (сольовим містком), що заповнена розчином електроліту, йони якого ʜе взаємодіють з іншими йонами в гальванічному елементі, наприклад натрій нітрату. У такий спосіб забезпечується електричний контакт між посудинами. Для того щоб розчин не виливався, кінці трубки закривають скловатою чи гелем, просоченим електролітом. Якщо електроди з’єднати дротинками з електричною лампочкою, то вона засвітиться.
Через деякий час в обох склянках можна спостерігати хімічні перетворення: Цинкова пластинка розчиняється, її маса зменшується, а на мідній пластинці з розчину осаджується мідь і маса мідної пластинки збільшується. Водночас послаблюється забарвлення розчину купрум(ІІ) сульфату (концентрація йонів Сu2+ знижується). Ці хімічні зміни є результатом перенесення електронів з однієї частини елемента до іншого, тобто це типовий електрохімічний процес. Відпрацьовані електроди
Окисно-відновні реакції, що відбуваються у гальванічному елементі. Катодом (окисником) є електрод, виготовлений з менш активного металу, електродний потенціал якого має більш додатне значення, - саме тому катод у схемах гальванічних елементів позначається знаком плюс. Анодом (відновником) є електрод, виготовлений з більш активного металу, у якого електродний потенціал має більш від’ємне значення, тому анод позначається знаком мінус.
Окисно-відновні реакції, що відбуваються у гальванічному елементі. На цинковому електроді елемента Якобі-Даніеля відбувається розчинення цинку з перетворенням його атомів на йони, тобто процес окиснення. Процес окиснення атомів цинку на аноді:(-) А: Zn0 - 2ē →Zn2+ Цинковий електрод в гальванічному елементі виступає як анод, він має негативний заряд. Чим більш активний метал, тим більше його катіонів переходить в розчин і тим більш негативно заряджена поверхня металу.
Окисно-відновні реакції, що відбуваються у гальванічному елементі. На мідному електроді відбувається осадження міді. Вивільнені електрони по провіднику переходять на мідний електрод, де відбувається розряджання катіонів Купруму (процес відновлення), що супроводжується виділенням металічної міді: Процес відновлення йонів Купруму на катоді:(+) К: Cu2+ + 2ē → Cu0 Мідний електрод в гальванічному елементі виступає як катод, він має позитивний заряд..
Сухий гальванічний елемент (батарейка)Найпоширеніший серед гальванічних елементів цього типу – манган-цинковий елемент, який винайшов французький хімік Ж. Лекланше ще у 1865 році Корпус цього елемента зроблено iз цинку; він виконує роль анода (це – негативний полюс джерела струму). Всередині метиться волога паста з манган(ІV) оксиду (Мп. О2), амоній хлориду (NH4 Cl) i графітового порошку. В пасту занурений графітовий стрижень, що виступає катодом (позитивний полюс). Елемент герметизовано смолою або воском.
Акумулятори. Батарейку можна використати лише один раз. Існують хімічні джерела струму, які періодично заряджають від електричної мережі й використовують знову. Це акумулятори. Вони є в мобільних телефонах, ноутбуках, фотоапаратах, автомобілях. Найпоширенішими є свинцеві, або кислотні, акумулятори, Їх робота ґрунтується на оборотній реакції
Велика біда від маленької батарейки. У зв’язку з інтенсивним застосуванням хімічних джерел струму набула актуальності проблема їх утилізації. В багатьох країнах, у тому числі в Україні, використані батарейки збирають; контейнери для них розміщують у супермаркетах, закладах освіти (мал. 22). На спеціалізованих підприємствах із батарейок вилучають цинк, деякі сполуки.
Не викидай батарейку у смітник. Відомо, що одна пальчикова батарейка забруднює 20 кв.м. ґрунту та 400 літрів води (!). Тож, якщо ви на протязі року викидаєте у сміттєвий бак 10 батарейок (від пульта, іграшок, годинника), цього буде достатньо аби забруднити та зробити непридатними для використання 4 000 літрів води, 200 кв.м. ґрунту (в лісі, це територія 20 дерев, 20 кротів, 10 їжаків, кількох десятків тисяч дощових черв'яків).
Чим же шкідливі метали, які містяться в батарейках?Свинець - викликає нервові розлади, важкі захворювання мозку, вражає нирки та печінку, кісткові тканини. Кадмій – накопичується в нирках, кістках, щитовидній залозі. Є канцерогеном, тобто провокує онкологічні захворювання. Вражає роботу кожного органу. Ртуть – впливає на мозок, нирки, печінку, нервову систему. Викликає погіршення зору, слуху, захворювання дихальних шляхів, порушення опорно-рухової системи. Луги – пропалюють шкіру і слизові оболонки.
. Гальванічні елементи – виготовлені в домашніх умовах Встроміть в яблуко два цвяхи – зілізний та мідний. Вони будть електродами. Електролітом служитиме яблучний сік. При з’єднані електродів првідником відбувається окисно – відновний процес. Залізо віддає елктрони і є анодом, а мідь – приєднує їх і є катодом.
-
 Крамар Світлана 15.11.2022 в 00:45щиро дякую за змістовну презентацію!Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Крамар Світлана 15.11.2022 в 00:45щиро дякую за змістовну презентацію!Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку































