Презентація до уроку "Кислоти та їх властивості. Урок-подорож до країни Кислот"













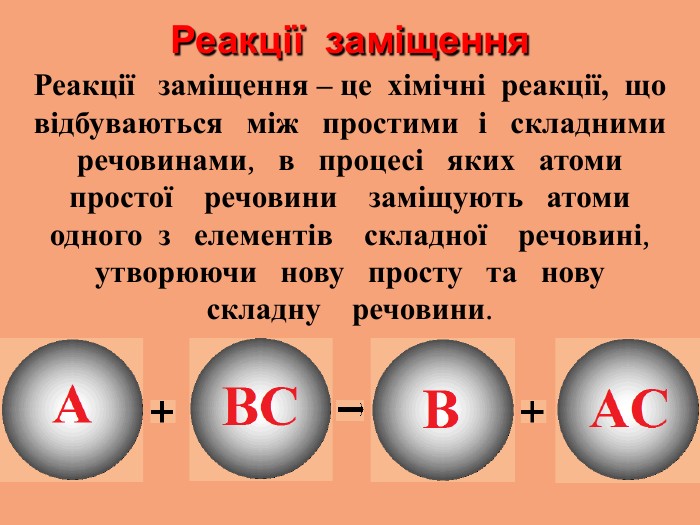

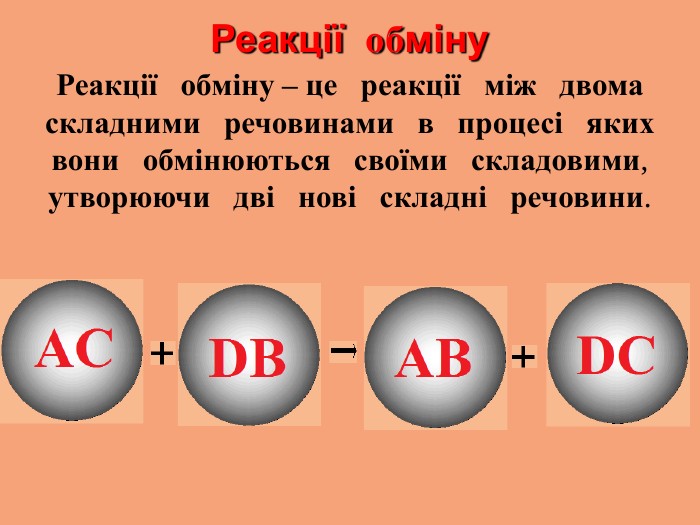





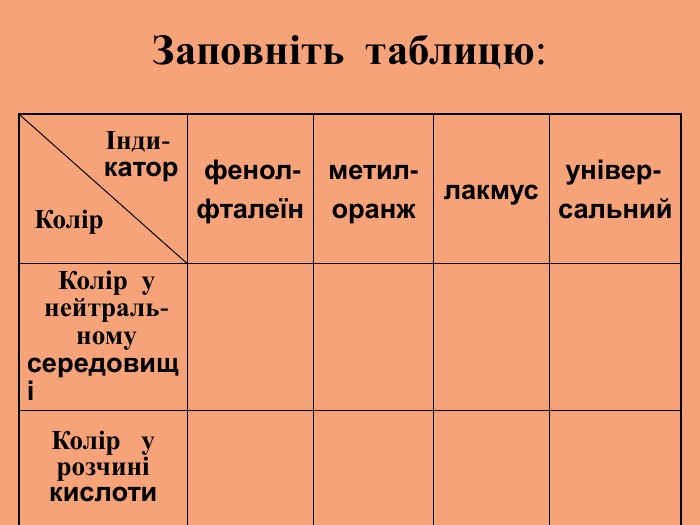





1.Чітко визначайте порядок і правила безпечного проведення досліду. 3.Речовини для досліду потрібно брати в кількостях, передбачених інструкцією. 2.Виконуйте тільки ту роботу, яка передбачена завданням. 1.Чітко визначайте порядок і правила безпечного проведення досліду. 3.Речовини для досліду потрібно брати в кількостях, передбачених інструкцією. 2.Виконуйте тільки ту роботу, яка передбачена завданням.
1)Проведіть досліди. 2)Зазначте у зошиті свої спостереження. 3)Складіть рівняння відповідних реакцій. 4) Сформулюйте висновок на основі спостережень: Які з використаних металів реагують з хлоридною кислотою? Який з використаних металів не реагує з кислотою? Який газ виділяється в результаті реакції?


про публікацію авторської розробки
Додати розробку