Презентація до уроку хімії у 8 класі на тему: "Кристалічні гратки"
Матеріал містить цікаву інформацію з ілюстраціями до уроку хімії у 8 класі на тему: "Кристалічні гратки".

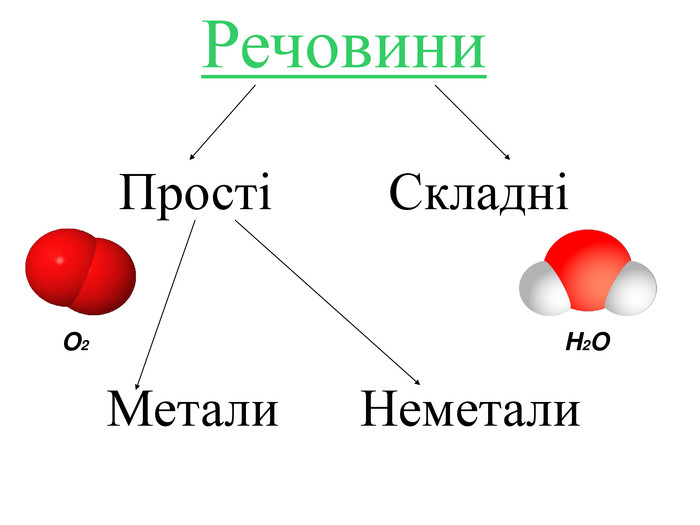












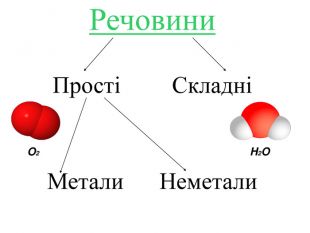
Перевірка домашнього завдання Завдання 1. Знайди мене (знайди сполуку, яка утворена з хімічних елементів з порядковими номерами 8 і 9; 53; 1 і 35; 19 і 17 (HBr, OF2, KCl, I2). Завдання 2. Впізнай мене (визначте тип хімічного зв'язку). Завдання 3. Склади мене (складіть схему утворення хімічного зв'язку). Завдання 4. Напиши мене (написати електронну та структурну формулу сполуки).
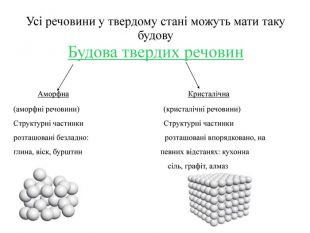
Усі речовини у твердому стані можуть мати таку будову Будова твердих речовин Аморфна Кристалічна (аморфні речовини) (кристалічні речовини) Структурні частинки Структурні частинки розташовані безладно: розташовані впорядковано, на глина, віск, бурштин певних відстанях: кухонна сіль, графіт, алмаз
Структурну впорядкованість кристалічних речовин називають кристалічними ґратками. Кристалічні речовини мають різні фізичні властивості. На цьому уроці ми маємо з'ясувати, яким чином побудовані кристалічні речовини і зрозуміти, від чого залежать їх властивості та дізнатись, що являють собою кристалічні ґратки. Структурну впорядкованість кристалічних речовин називають кристалічними ґратками. На уроці ми маємо: 1. з'ясувати, яким чином побудовані кристалічні речовини; 2. дізнатись, що являють собою кристалічні ґратки та які є типи кристалічних ґраток; 3. зрозуміти, від чого залежать властивості речовин; 4. вміти визначати типи кристалічних ґраток, прогнозувати властивості речовин залежно від виду хімічного зв'язку і типу кристалічних ґраток.
Тема уроку: Кристалічні ґратки. Атомні, молекулярні та йонні кристали. Залежність фізичних властивостей речовин від типів кристалічних кристалічних ґраток Мета: - навчальна: дати поняття про кристалічні ґратки; ознайомити з різними типами кристалічних ґраток; показати взаємозв'язок між будовою речовин та їх фізичними властивостями на підставі знань про типи хімічних зв'язків та типи кристалічних ґраток; - розвиваюча: розвивати вміння характеризувати фізичні властивості речовин за типом кристалічних ґраток і видом хімічного зв'язку; вміння працювати з опорною таблицею, карткою-інструкцією. - виховна: виховання самостійності, наполегливості в досягненні своєї мети, культури праці.
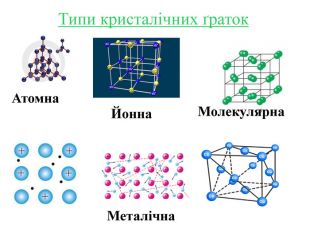
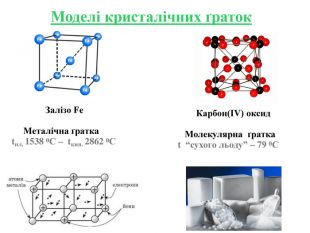
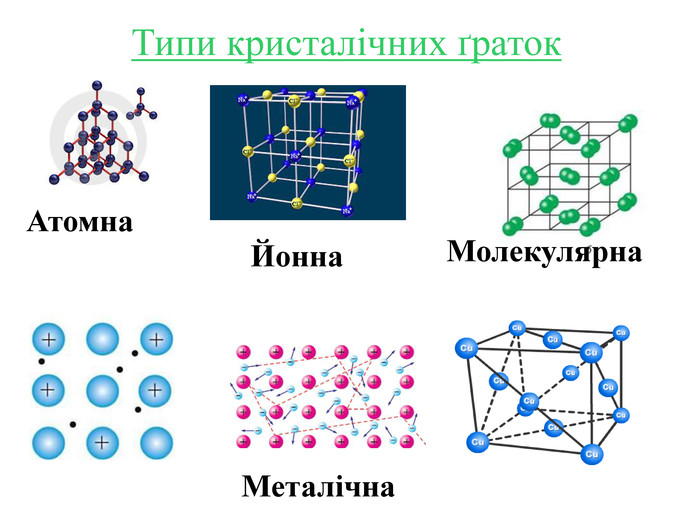
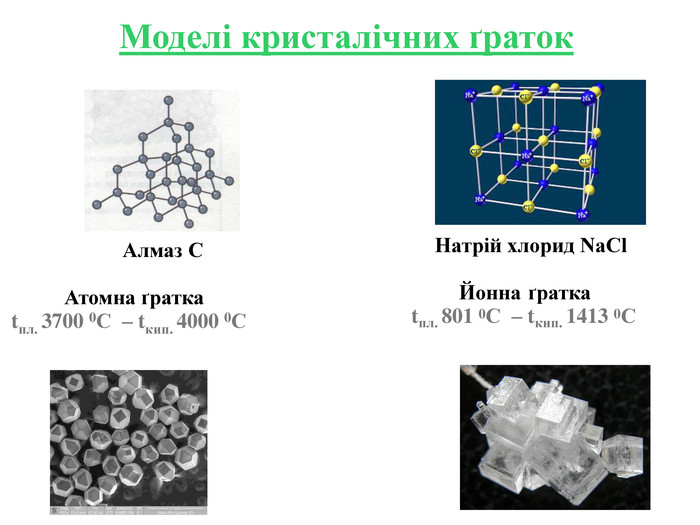
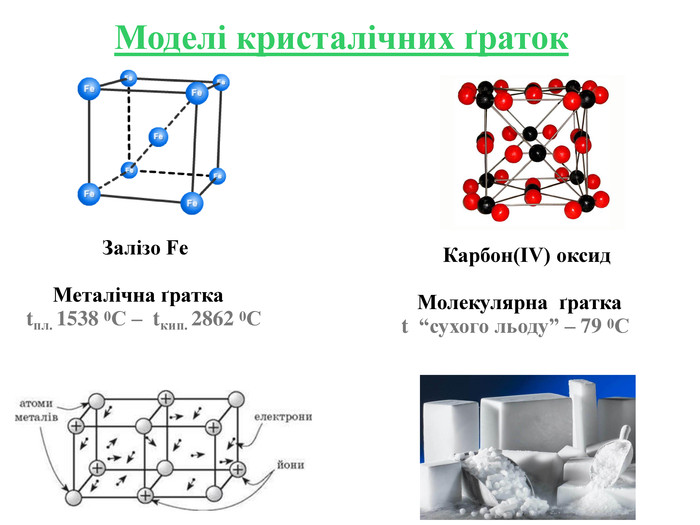
Кристалічні ґратки — модель, за допомогою якої описують внутрішню будову кристалів. Місця, в яких прямі лінії перетинаються, що об'єднують центри структурних частинок, називають вузлами кристалічних ґраток. Залежно від природи частинок, що містяться у вузлах кристалічних ґраток та сили взаємодії між частинками, визначають типи ґраток: атомні, молекулярні, йонні, металічні.
Інструкція з визначення типу кристалічної ґратки Визначити до якої групи відноситься дана речовина: 1. Проста речовина – визначити метал чи неметал: Ме – мають металічну кристалічну ґратку Fe; неМе – мають молекулярну кристалічну ґратку I2; винятки – деякі неМе мають атомну кристалічну ґратку C. 2. Складна речовина – визначити клас речовини: МехОу – йонну кристалічну ґратку Al2O3; неМехОу – молекулярну кристалічну ґратку СО2, P2O5,; Ме(ОН)х – йонну кристалічну ґратку Cu(OH)2; НхAn – йонну кристалічну ґратку H2SiO3; MeхAnу – йонну кристалічну ґратку BaCl2, K3PO4, Cа(NO3)2. Інструкція з визначення типу кристалічної ґратки Визначити до якої групи відноситься дана речовина: 1. Проста речовина – визначити метал чи неметал: Ме – мають металічну кристалічну ґратку Fe; неМе – мають молекулярну кристалічну ґратку I2; винятки – деякі неМе мають атомну кристалічну ґратку C. 2. Складна речовина – визначити клас речовини: МехОу – йонну кристалічну ґратку Al2O3; неМехОу – молекулярну кристалічну ґратку СО2, P2O5; Ме(ОН)х – йонну кристалічну ґратку Cu(OH)2; НхAn – йонну кристалічну ґратку H2SiO3; MeхAnу – йонну кристалічну ґратку BaCl2, K3PO4, Cа(NO3)2.
Фізкультхвилинка Встати, ноги на ширині плеч, руки в боки і за сигналом керівника нахилитися праворуч, ліворуч, вперед і назад (двічі). Випрямити руки, виконати кілька обертів кистями рук. 1. Встати, ноги на ширині плеч, руки в боки і за сигналом керівника нахилитися праворуч, ліворуч, вперед і назад (двічі). 2. Випрямити руки, виконати кілька обертів кистями рук.
Закріплення знань Прийом “Мікрофон” Евристичні питання 1. Камфора – легкокипляча речовина, яку здавна використовували в медицині для приготування розігріваючих компресів. Вона міститься у деревині камфорного лавра великого вічнозеленого дерева, яке росте в Азії. Яка кристалічна ґратка в цієї речовини? Відповідь обґрунтуйте.
Підведення підсумків уроку – Що нового ви дізналися на уроці про будову речовин? – З якими типами кристалічних ґраток ви познайомилися на уроці? – Чим зумовлений той чи інший тип кристалічних ґраток речовин у твердому агрегатному стані? – Як називаються речовини, які не мають кристалічних ґраток?


про публікацію авторської розробки
Додати розробку