Презентація до уроку «Моделі молекул. Ненасичені вуглеводні. Етилен та ацетилен як представники ненасичених вуглеводнів»
Розробка уроку«Моделі молекул. Ненасичені вуглеводні. Етилен та ацетилен як представники ненасичених вуглеводнів»
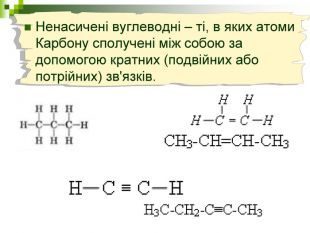
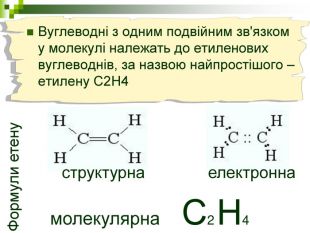
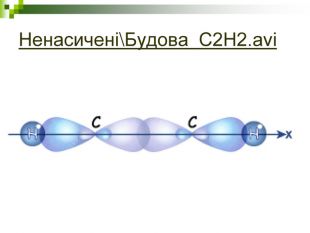
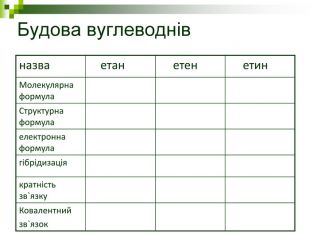
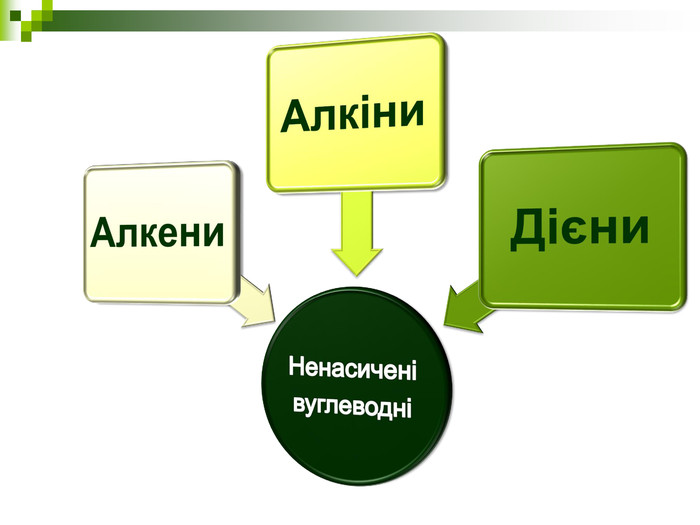
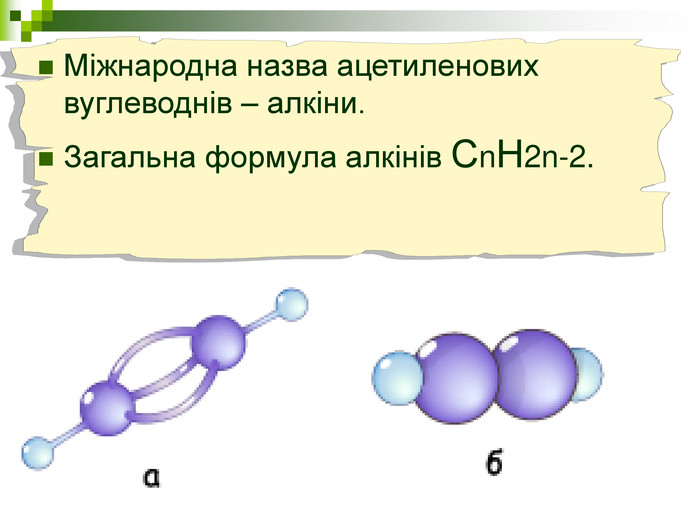
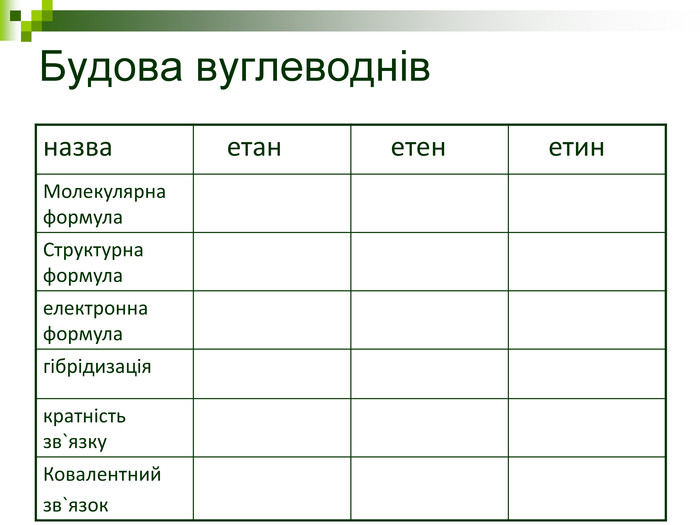
Мета: Навчити складати молекулярні і структурні формули гомологів метану, дати їм назви. Ознайомити із зигзагоподібною будовою карбонового ланцюга, фізичними властивостями. Дати поняття про ненасичені вуглеводні на прикладах етилену (етену) і ацетилену (етіну). Порівняти склад, структурні, електронні формули етану, етену і етіну. Ввести поняття кратності зв'язку: одинарний, подвійний, потрійний. Ознайомити з гомологами ряду етилену (алкенами), гомологами ряду ацетилену(алкінами).













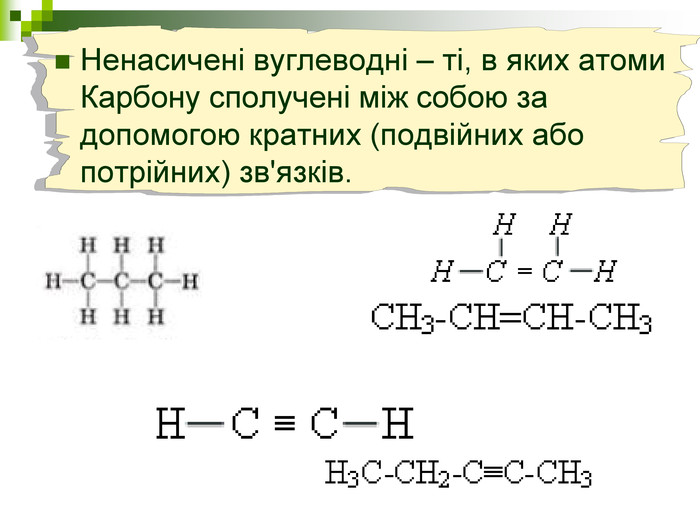



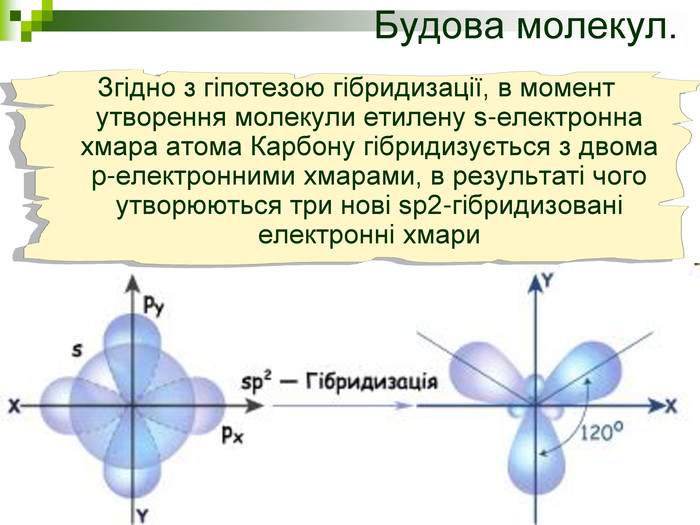
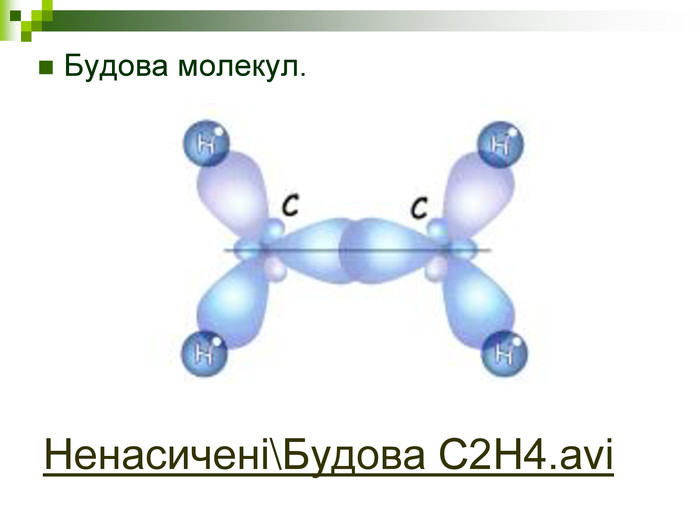

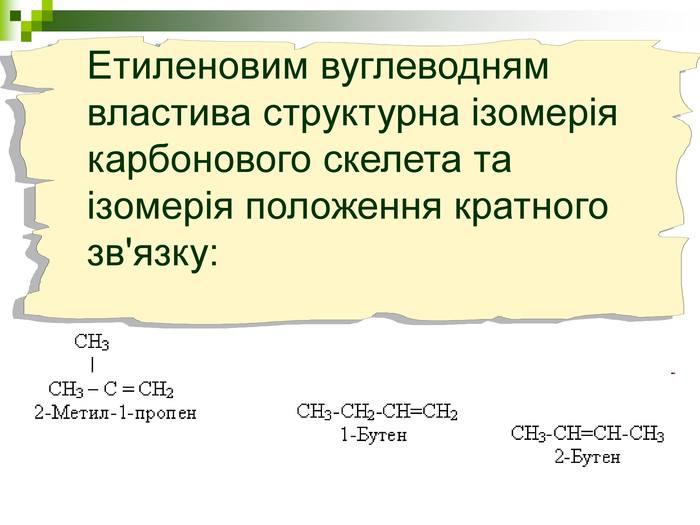
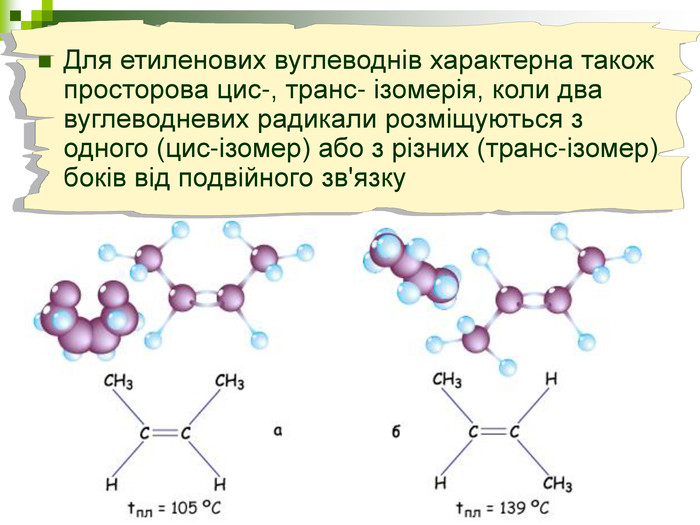













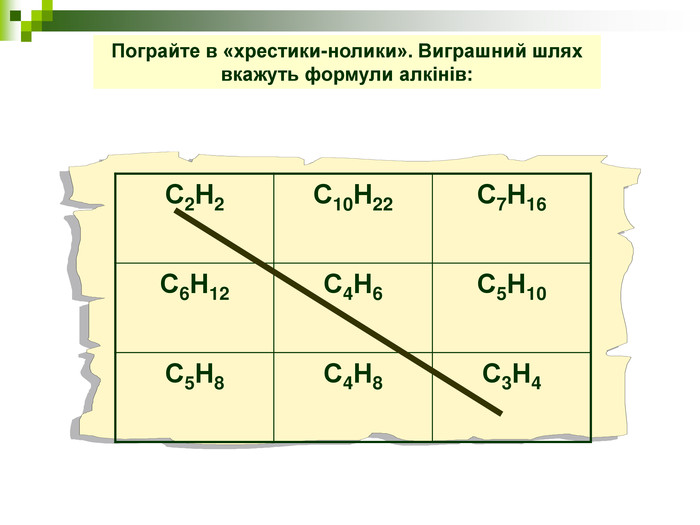
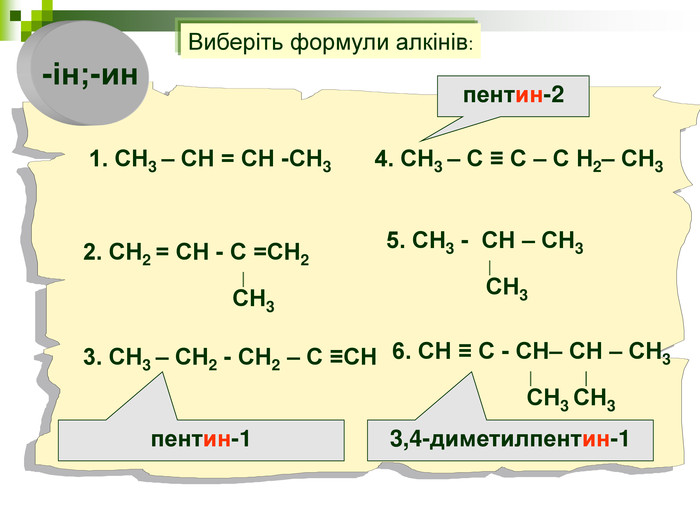



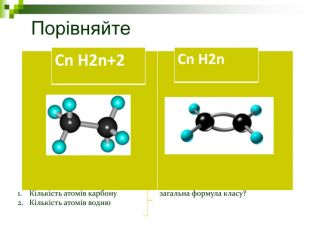
Хімічна розминка (мозкова атака) Що вивчає органічна хімія? Чому говорять що органічна хімія - це хімія сполук Карбону? Яку валентність виявляє атом Карбону в органічних сполуках? Які органічні сполуки ми вивчили на попередніх уроках? Яка загальна формула насичених вуглеводнів? Які речовини називають ізомерами? В які реакції вступають насичені вуглеводні, та чому?
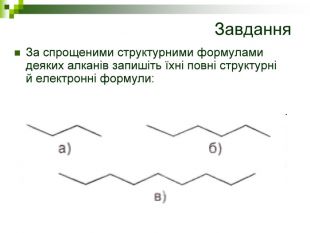
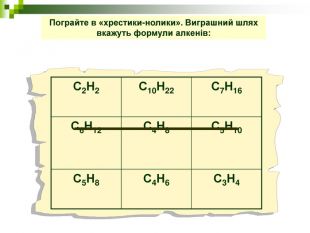
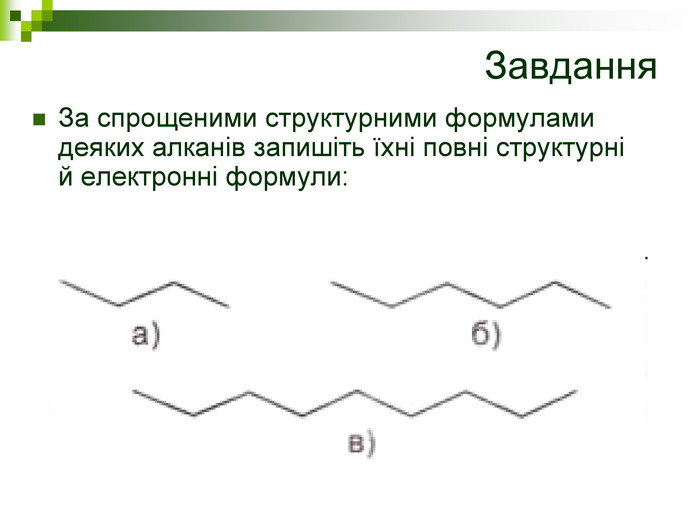
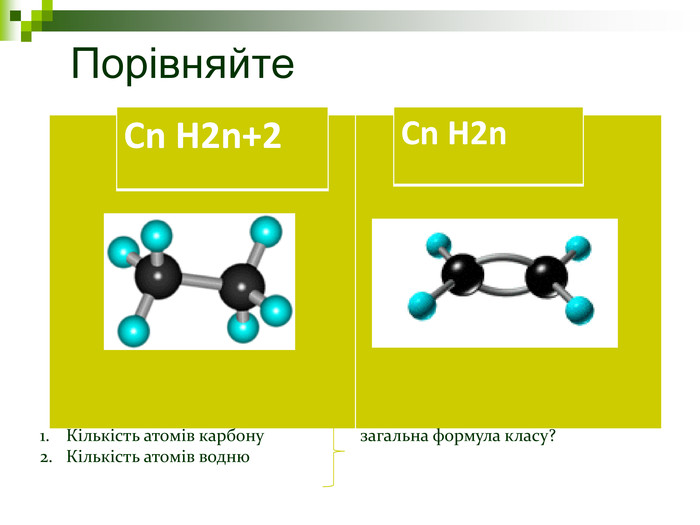
Завдання Запишіть молекулярні формули алканів, у складі яких: а) 2; б) 5; в) 17 атомів Карбону. Назвіть перші 5 членів гомологічного ряду метану з непарною кількістю атомів Карбону в молекулі. Виберіть загальну формулу вуглеводнів гомологічного ряду метану: а) СnН2n; б) СnН2n-2; в) СnНn+2; г) СnН2n+2. Алкан з найдовшими молекулами синтезували 1985 р. англійські хіміки І. Бідд і М.К. Уайтинг. Це нонаконтатриктан, молекула якого містить 390 атомів Карбону, Виберіть кількість атомів Гідрогену у молекулі цієї речовини: а)197; б)390; в)780; г)782.
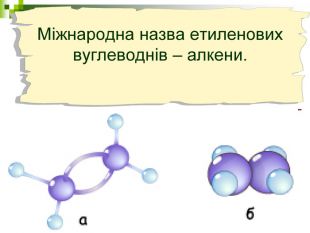
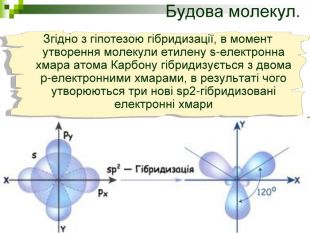
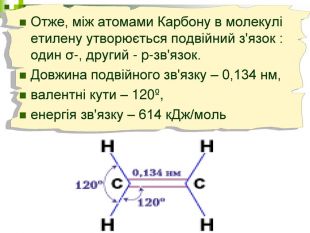
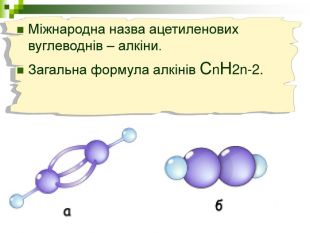
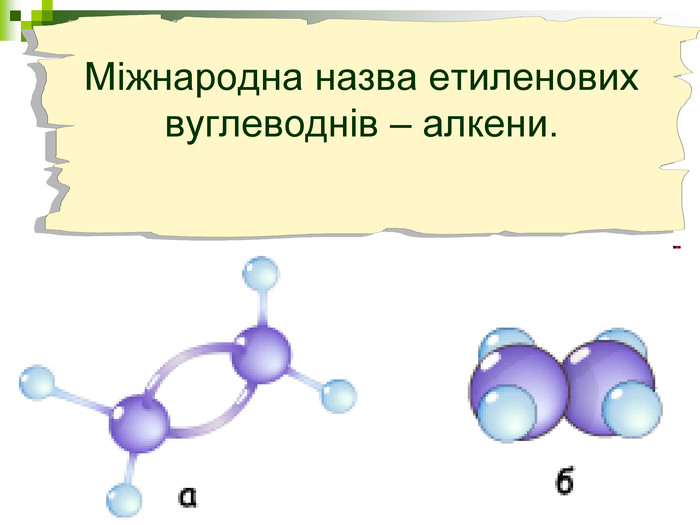
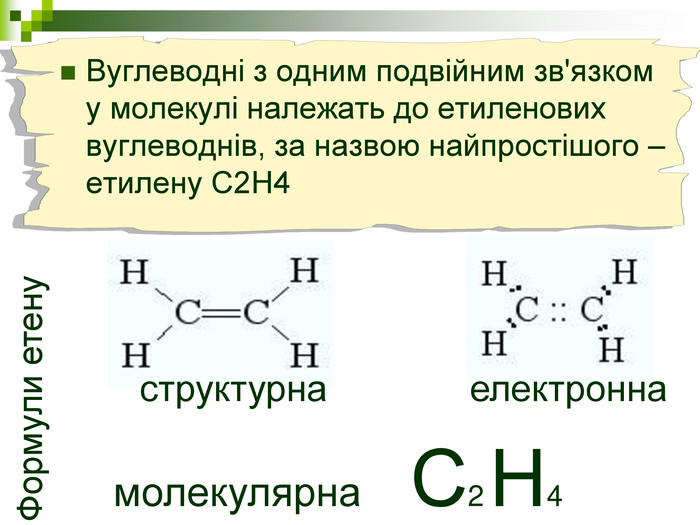
Мета уроку: Навчити складати моделі молекул, гомологічного ряду метану. Ознайомити із зигзагоподібною будовою карбонового ланцюга, фізичними властивостями. Дати поняття про ненасичені вуглеводні на прикладах етилену (етену) і ацетилену (етіну). Порівняти склад, структурні, електронні формули етану, етену і етіну. Ввести поняття кратності зв’язку: одинарний, подвійний, потрійний. Ознайомити з гомологами ряду етилену (алкенами), гомологами ряду ацетилену (алкінами).
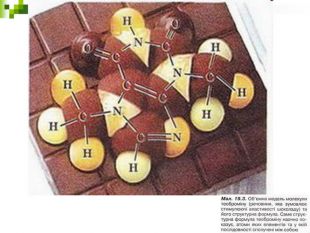
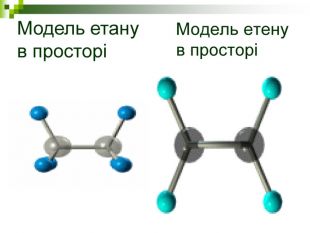
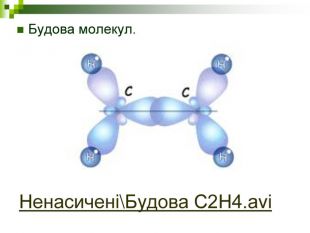
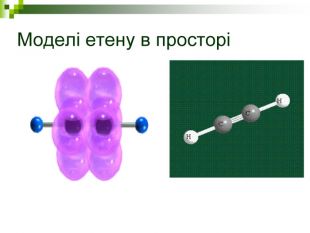
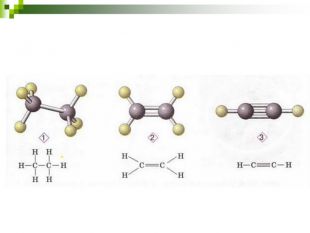
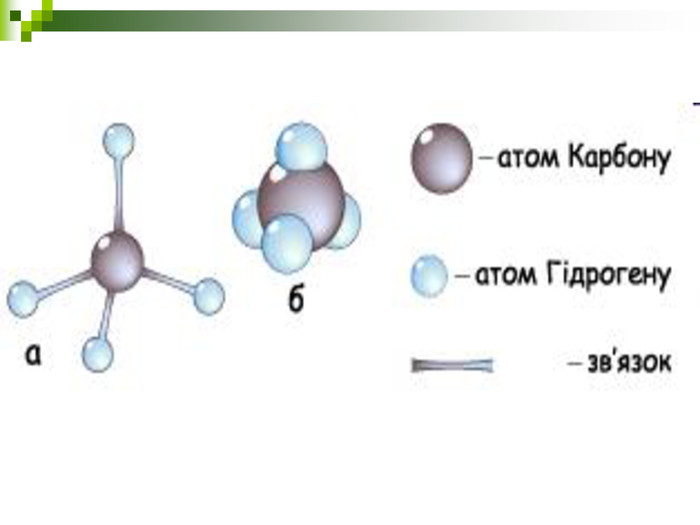
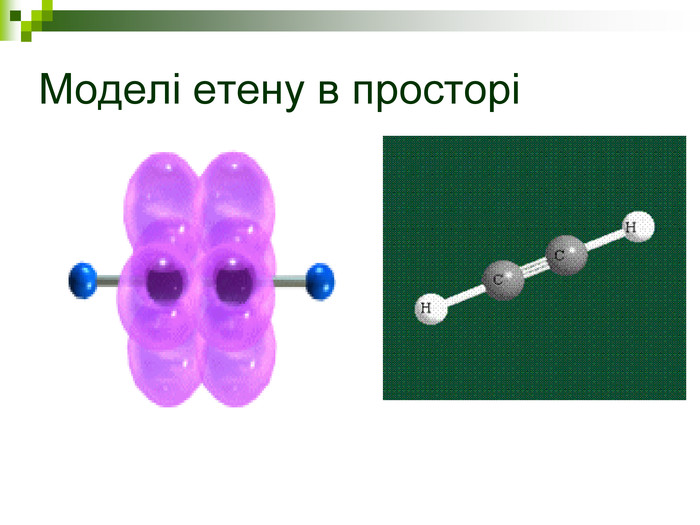
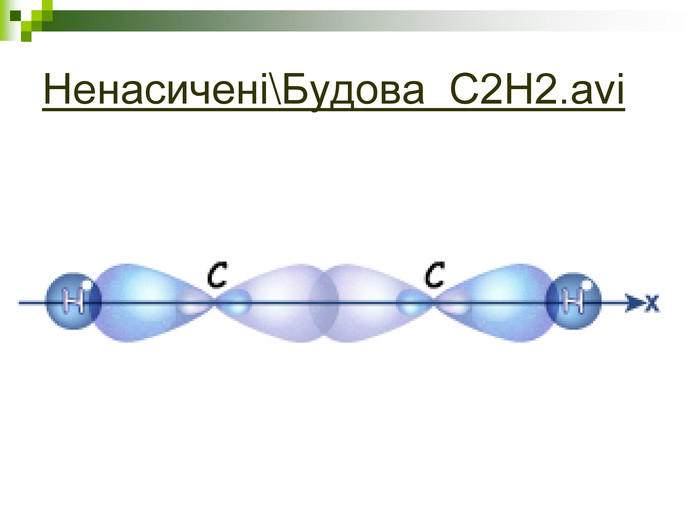
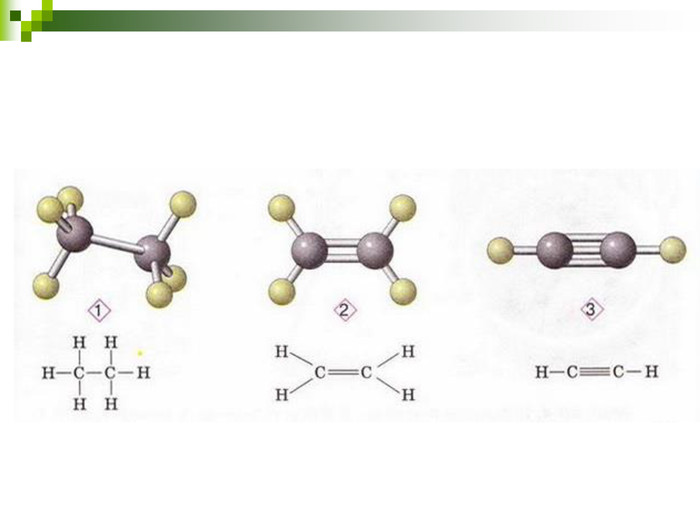
Моделі молекул, так само, як і моделі атомів, кристалів тощо, допомагають зримо уявити собі реальні об'єкти, безпосереднє спостереження за ЯКИМИ проводити незручно або неможливо. Моделювання - це вивчення явища або об'єкта за допомогою його замінників, аналогів (моделей). За його допомогою науковці пояснюють закони природи, перевіряють гіпотези, прогнозують існування об'єктів та явищ, які дотепер не спостерігали.
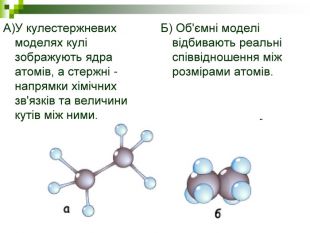
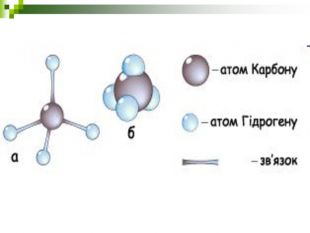
Хімічні моделі умовно поділяють на знакові (символьні) та матеріальні, Знакові моделі - це символи елементів, хімічні формули, рівняння реакцій тощо. Матеріальні моделі - моделі атомів, йонів, кристалів, молекул, хімічних приладів і промислових апаратів хімічних виробництв. Для моделювання молекул найчастіше використовують кулестержневі та об'ємні моделі. Вони лише відображають структуру мікрооб'єктів, принципи їхньої будови, однак не відтворюють зовнішнього вигляду.
ЛАБОРАТОРНИЙ ДОСЛІД Виготовлення моделей молекул вуглеводнів Завдання. Виготовте моделі молекул метану, етану, пропану, бутану, пентану та підготуйте план складання моделей. Обладнання: пластилін темного і світлого кольорів, сірники або набір для складання кулестержневих моделей молекул. Об'єднайтеся в групи, ознайомтеся із завданням, кожен з вас має спочатку записати формулу вуглеводню, який моделюватиме ваша група. Усі члени групи виготовлятимуть модель одного й того самого вуглеводню. Разом складіть план її виготовлення. Порівняйте готові моделі і складені плани, виокремте ті пункти плану, які можна використати для самоконтролю.
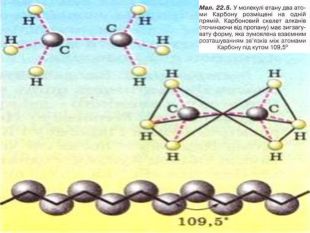
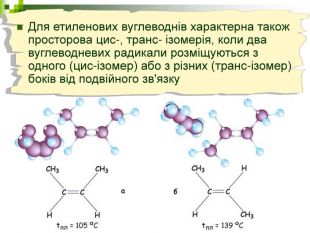
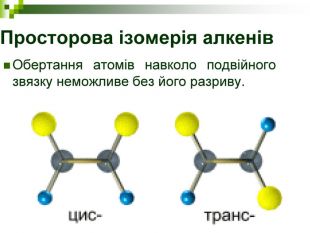
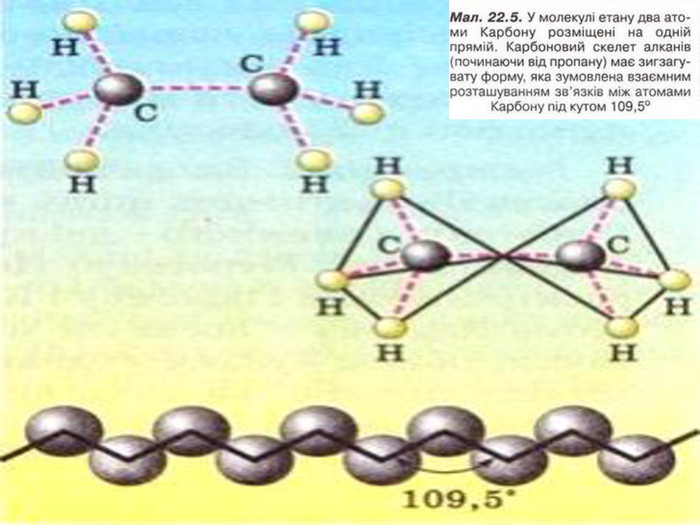
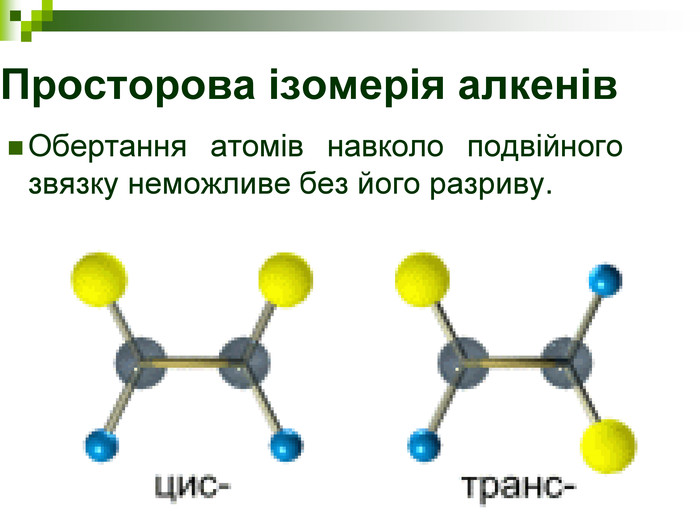
Порівняйте плани моделювання та моделі молекул етану, пропану, бутану, пентану. У чому їх подібність і відмінність? Яка валентність Карбону в молекулах вуглеводнів? Чим зумовлена зигзагувата будова карбонового ланцюга? Чи можливе вільне обертання атомів навколо карбон-карбонових зв'язків? Поясніть, для чого моделюють молекули речовин.
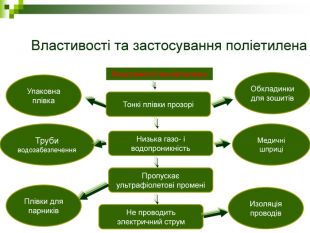
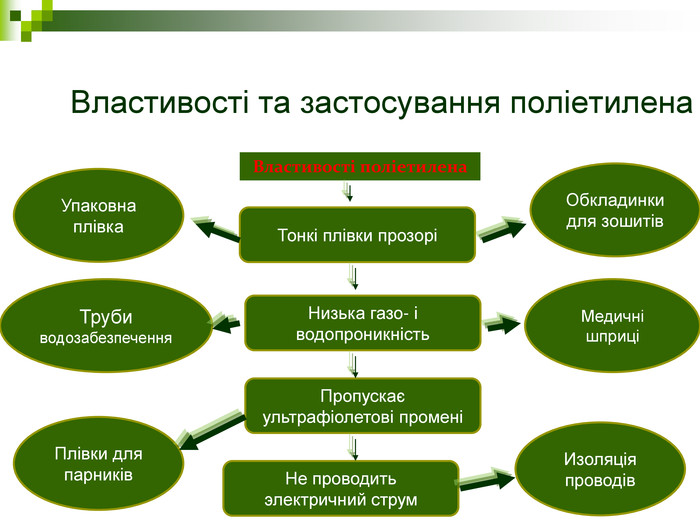
Властивості та застосування поліетилена Труби водозабезпечення Обкладинки для зошитів Плівки для парників Медичні шприці Изоляція проводів Упаковна плівка Тонкі плівки прозорі Низька газо- і водопроникність Пропускає ультрафіолетові промені Не проводить электричний струм Властивості поліетилена


про публікацію авторської розробки
Додати розробку