Урок на тему" Окисно- відновні реакції"
Урок на тему " Окисно-відновні реакції. Значення окисно-відновних реакцій у природі та житті людини ". Мета: навчитися відрізняти окисно-відновні реакції за їх рівняннями; сформувати вміння визначати процеси окиснення та відновлення, окисник і відновник за рівнянням хімічної реакції; розширити та систематизувати знання про значення овр у природі та житті людини
Тема: Окисно-відновні реакції. Метод електронного балансу. Значення окисно-відновних реакцій.
Мета: узагальнити й поглибити знання учнів про окисно-відновні реакції, закріпити навички складання електронного балансу для окисно-відновних реакцій, а також уміння визначати окисник і відновник за рівнянням хімічної реакції; розширити та систематизувати знання про ОВР та їх значення у природі й у житті людини, розвивати вміння аналізувати та узагальнювати інформацію.
Тип уроку: комбінований.
Хід уроку.
І. Організаційний етап.
- Вступне слово вчителя.
Привітання, створення в учнів позитивного, емоційного настрою, включення в діяльність.
- Інтерактивний прийом «Я вітаю».
Учитель вимовляє «Я вітаю тих, хто…, додаючи фразу: «...вже прокинувся; випив чаю; не снідав; хоче працювати; має на собі щось червоне; у доброму гуморі; хоче спілкуватися; хотів би дізнатися щось нове; не виконав домашнє завдання з хімії тощо ( учні, якщо згодні на відповідь піднімають руку)
ІІ. Перевірка домашнього завдання.
- Бесіда.
- Дайте визначення поняття «хімічна реакція».
- Які вам відомі ознаки хімічних реакцій?
- За якими ознаками класифікують хімічні реакції?
ІІІ. Актуалізація опорних знань.
Слово вчителя.
Сьогодні на уроці ми маємо узагальнити, систематизувати й поглибити ваші знання про ОВР, сконцентрувати увагу на практичному значенні цих реакцій у промисловій техніці, природі.
Тому для початку визначимо основні поняття, що стосуються теми уроку.
Учні називають поняття: ступінь окиснення, окисник, відновник, процес окиснення, процес відновлення, атом.
Ступінь окиснення елемента — це умовний заряд атома в речовині, обчислений із припущенням, що вона складається з іонів. Ступінь окиснення характеризує число умовно прийнятих або умовно відданих електронів. Ступінь окиснення може бути позитивним(якщо атом віддав електрони), негативним (якщо атом прийняв електрони) або дорівнювати нулю. Він позначається арабською цифрою зі знаком «плюс» або «мінус» над символом елемента. Для визначення ступеня окислення елементів необхідно запам’ятати певні правила:
1. При визначенні ступенів окиснення виходять з електронегативності речовини: сума ступенів окиснення всіх атомів у сполуці дорівнює нулю.
2. Ступінь окиснення атомів в простій речовині дорівнює нулю.
3. Атомам деяких хімічних елементів звичайно приписують сталі ступені окиснення. Наприклад, ступінь окиснення Флуору в сполуках завжди дорівнює –1; Літію, Натрію, Калію, Рубідію і Цезію +1; Магнію, Кальцію, Стронцію, Барію і Цинку +2, Алюмінію +3.
4. Ступінь окиснення Гідрогену в більшості сполук +1, і лише в сполуках з деякими металами він дорівнює –1 (![]() ,
, ![]() ).
).
5. Ступінь окиснення Оксигену в більшості сполук –2, і лише в деяких сполуках йому приписують ступінь окиснення –1 (![]() ,
, ![]() або +2 (
або +2 (![]() ).
).
6. Атоми багатьох хімічних елементів виявляють змінні ступені окиснення.
7. Ступінь окиснення атома металу в сполуках позитивний і чисельно дорівнює його валентності.
8. Максимальний позитивний ступінь окиснення елемента, як правило, дорівнює номеру групи в періодичній системі, в якій знаходиться елемент.
9. Мінімальний ступінь окиснення для металів дорівнює нулю. Для неметалів у більшості випадків нижчий негативний ступінь окиснення дорівнює різниці між номером групи та цифрою вісім.
10. Ступінь окиснення атома, що утворює простий йон (складається з одного атома), дорівнює заряду цього йона
Завдання (усно).
Визначити кількість електронів, відданих або приєднаних атомами, вказати процеси окиснення та відновлення в таких схемах.
|
S° |
→ |
S+4 |
|
N+5 |
→ |
N+2 |
|
Zn° |
→ |
Zn+2 |
|
Cl2° |
→ |
2Cl- |
|
Fe+2 |
→ |
Fe+3 |
|
Ag+ |
→ |
Ag° |
|
2О-2 |
→ |
О2° |
|
P° |
→ |
P-3 |
Завдання.
Визначити ступені окиснення елементів у сполуках:
CO2, H2 S, CuCl2, N2, Fe2O3, O2, HNO3, HCl.
ІV. Вивчення нового матеріалу.
- Розповідь учителя.
Для окисно-відновних реакцій існує зручний спосіб добору коефіцієнтів у рівняннях, названий методом електронного балансу.
Складаючи електронний баланс, бажано дотримуватися певного алгоритму. Відомо, що під час грозових процесів азот сполучається з киснем з утвореним нітроген (ІІ) оксиду, який далі перетворюється на нітроген (ІV) оксид, і на землю ллються кислотні дощі:
N2 + O2 = 2NO
2NO + O2 = 2NO2
2NO2 + H2O = HNO3 + HNO2
Завдяки цим процесам від 4 до 15 кг атомів Нітрогену потрапляє на гектар землі за рік.
Завдання: скласти електронний баланс, розставити коефіцієнти, визначити відновник і окисник, процес окиснення і відновлення.
Окисно – відновні реакції є всюди.
Вони лежать в основі багатьох процесів життєдіяльності. У сучасній хімії ОВР – один з головних методів одержання нових речовин. З допомогою цих реакцій одержують метали, кислоти, ліки, барвники.
Повідомлення учнів.
Перший учень
Окисно-відновні реакції найбільш поширені і відіграють значну роль у природі. Вони є основою життєдіяльності, адже з ними пов’язані найважливіші функції живої системи – це дихання, обмін речовин, фотосинтез у рослин. Під час дихання органічні речовини окиснюються до кінцевих продуктів- вуглекислого газу і води, використовуючи для цього кисень.А під час фотосинтезу вуглекислий газ відновлюється в органічних сполуках, а кисень вивільняється у повітря.
Процеси гниття, бродіння, тління, утворення перегною; утворення мінеральних солей з перегною в ґрунті - це все окисно-відновні реакціії. Дуже велике значення окисно-відновних реакцій в природі полягає в тому, що за допомогою цих реакцій постійно відбувається кругообіг всіх хімічних елементів, які входять до складу живих організмів: Оксигену, Карбону, Нітрогену, Гідрогену.
Процес фотосинтезу:
6C+4O2-2 + 6H2+1O-2 = C60H12+1O6-2 + 6O20
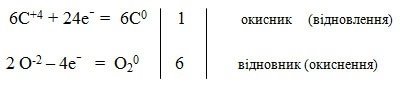
Другий учень. Окисно-відновні реакції мають велике значення і в житті людини - це отримання тепла в наших домівках при спалюванні вугілля, дров, газу; добування багатьох органічних речовин; виробництво цілого ряду будівельних матеріалів; виробництво лікарських препаратів, харчових та кормових добавок, вітамінів, гормонів, ферментів; виробництво кисло-молочних продуктів, сирів, пива, спирту, і багатьох інших продуктів.
Природоохоронні заходи, які застосовують для очищення навколишнього середовища, а саме стічних вод і ґрунту від побутового і промислового забруднення ґрунтуються на процесах окиснення та відновлення. Певні види бактерій здатні розкладати, мінералізувати органічні сполуки, які потрапляють у воду та грунт.
Окисно-відновна реакція спалювання вугілля:

Третій учень. Значення окисно-відновних реакцій в техніці дуже велике. Більшість рідкісних, важливих в техніці металів(нікель, вольфрам, молібден, хром, алюміній та інш.) отримують за допомогою окисно-відновних реакцій. Лужні метали такі як натрій, калій, лужноземельні – кальцій, барій отримують шляхом електролізу із їх солей. В основі електролізу лежать теж окисно-відновні реакції.
Виробництво чавуну, сталі, добування деяких неметелів: фосфору, хлору, йоду; добування амоніаку, нітратної та сульфатної кислот ґрунтується також на окисно-відновних процесах.
Дуже негативний процес відбувається в техніці з метелами теж на основі окисно-відновних реакцій – це корозія (руйнування) металів, утворення іржі. Для того, щоб уникнути цього явища застосовують захисні покриття.
Горіння палива в топках теплових електростанцій, в двигунах внутрішнього згорання та багато інших прикладів можна привести окисно-відновних процесів в техніці.
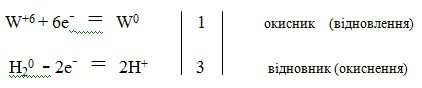
Реакція добування вольфраму:
W+6O3-2 + 3H20 = W0 + 3H2+1O-2щш
V. Узагальнення та закріплення знань.
- Завдання для закріплення знань.
Скласти електронний баланс, визначити окисник і відновник.
NаBr +H2 = NaCl + Br2
Al + V2O5 = Al2O3 + V
NH3 + O2 = N2 + H2O
H2 SO4 + I2 + H2O = H2 SO4 + HI
Zn + HNO3(кон) = Zn(NO3)2 +2NO2 + 2H2O
HgO = Hg + O2
VІ. Домашнє завдання.
Повторити § 16, виконати письмово № 6,7,8, 9 ст. 108-109.
VІІ. Підбиття підсумків уроку.


про публікацію авторської розробки
Додати розробку
