Презентація до уроку на тему "Місце металічних елементів у періодичній системі, особливості будови атомів, металічний зв’язок. Фізичні властивості металів"
Про матеріал
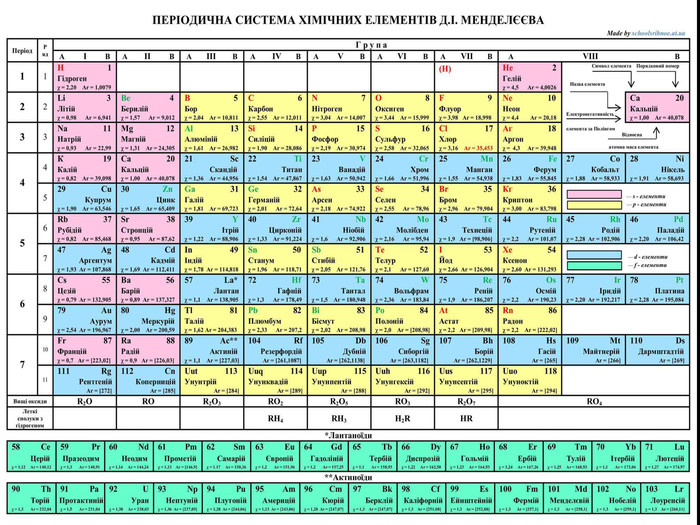
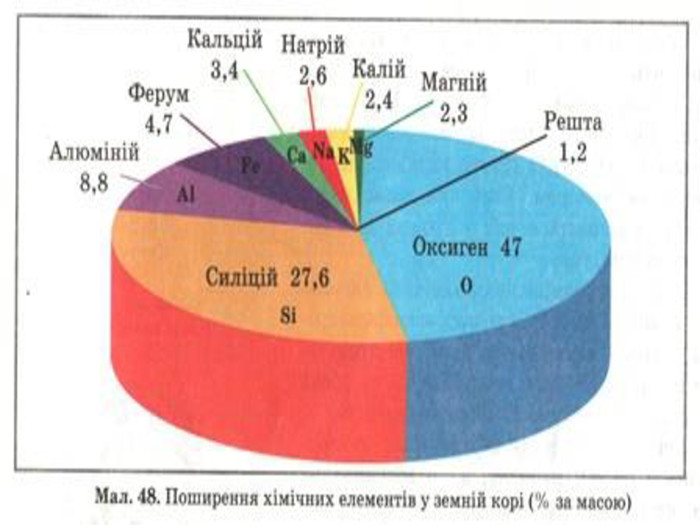
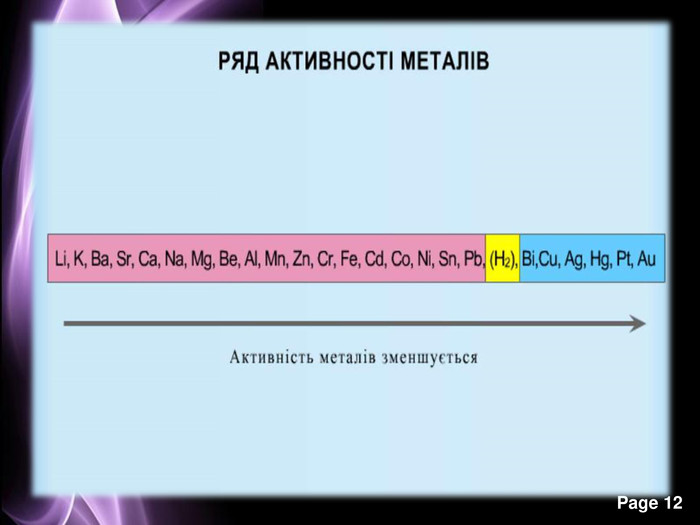
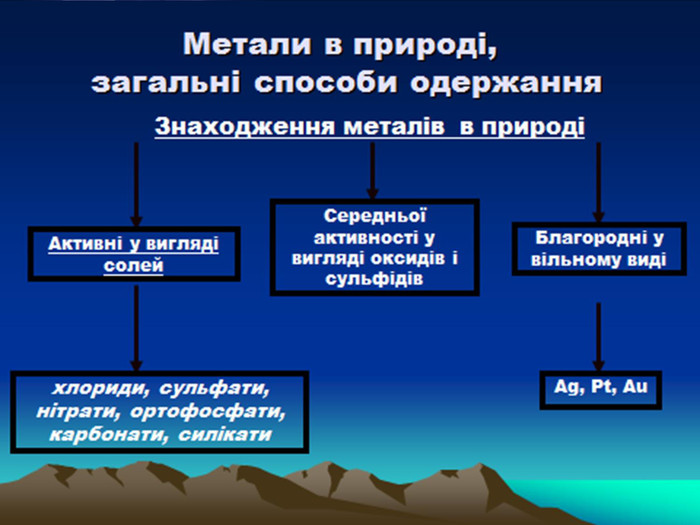
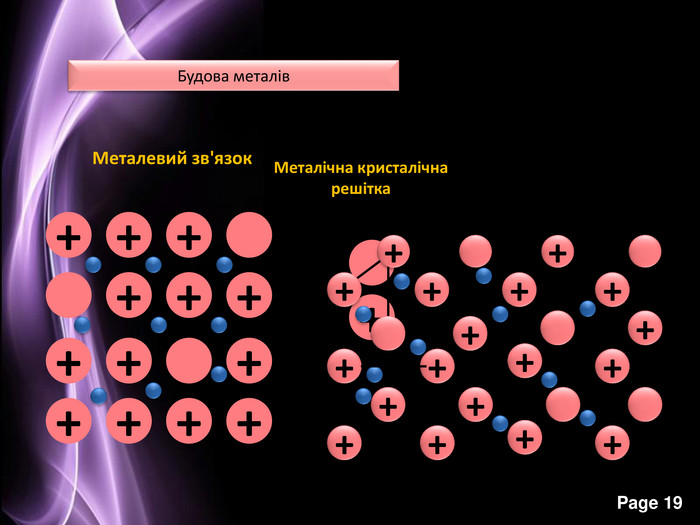
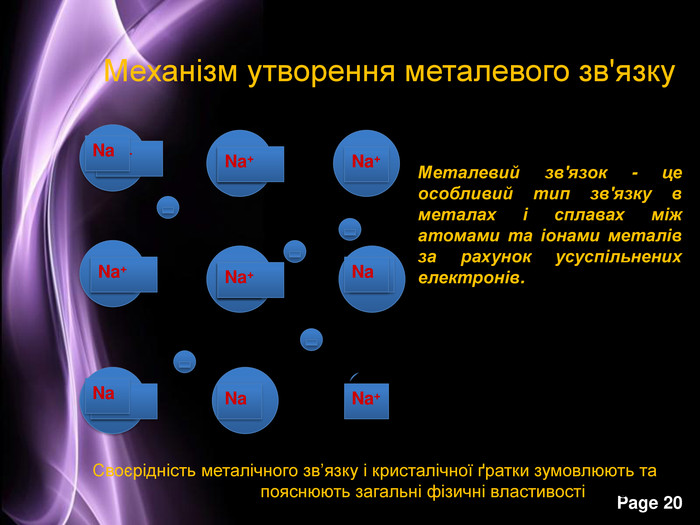
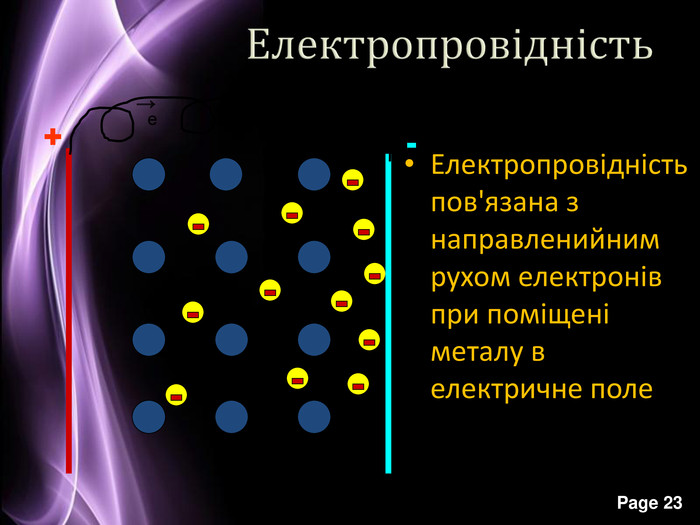
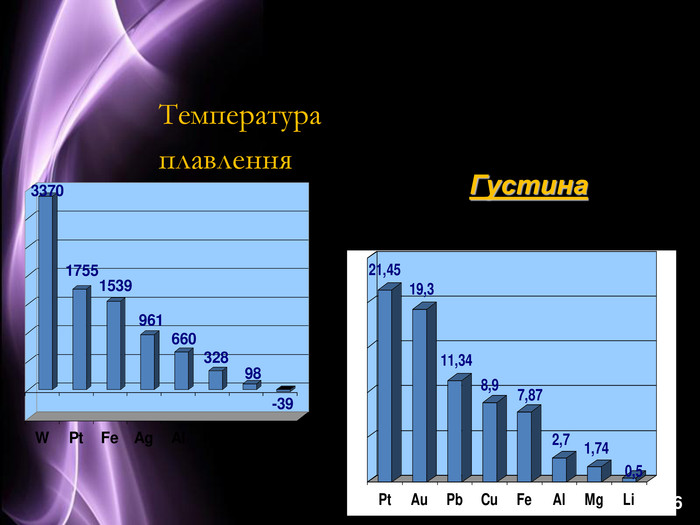
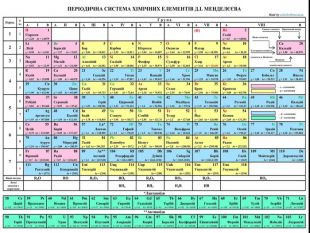
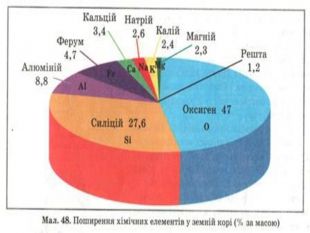
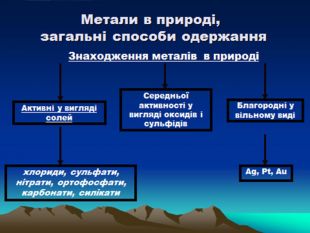
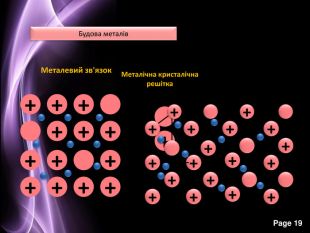
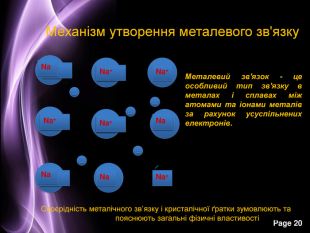
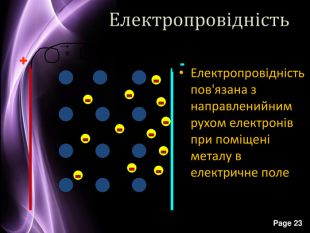
Презентація до уроку з хімії на тему: "Місце металічних елементів у періодичній системі, особливості будови атомів, металічний зв'язок. Фізичні властивості металів", для учнів 11 класів, для кращого зорового засвоювання.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку