Урок, презентація, публікація «Поняття про твердість води. Використання найважливіших сполук Кальцію».
Підтема: «Поняття про твердість води. Використання найважливіших сполук Кальцію» входить до теми «Металеві елементи та їхні сполуки». Згідно з програмою на тему відводиться 13 годин.
Для вивчення теми виділені наступні підтеми:
1.Положення металічних елементів у періодичній системі, особливості будови атомів. Металічний зв'язок.
2.Фізичні властивості та застосування металів.
Лабораторний дослід 9. Ознайомлення зі зразками металів.
3.Характерні хімічні властивості металів, корозія металів.
4.Лужні метали. Натрій і Калій. Оксиди, гідроксиди, солі Натрію і Калію. Використання найважливіших сполук Натрію і Калію. Калійні добрива.
Лабораторний дослід 10. Ознайомлення зі зразками сполук Натрію і Калію.
5.Лужноземельні метали і Магній. Кальцій. Кальцій оксид і гідроксид. Солі Кальцію.
Лабораторний дослід 11. Ознайомлення зі зразками сполук Кальцію і Магнію.
6.Поняття про твердість води. Використання найважливіших сполук Кальцію.
Лабораторний дослід 12. Усунення накипу з поверхні побутових приладів.
7.Алюміній. Алюміній оксид, гідроксид, їх амфотерність. Солі Алюмінію. Використання найважливіших сполук Алюмінію.
Лабораторний дослід 13. Добування Алюміній гідроксиду і доведення його амфотерності.
8.Ферум. Залізо. Ферум (ІІ) і Ферум (ІІІ) оксиди, відповідні їм гідроксиди, їх амфотерність. Солі Феруму. Використання найважливіших сполук Феруму.
Лабораторний дослід 14. Добування Ферум (ІІ) та Ферум (ІІІ) гідроксидів реакцією обміну.
9.Практична робота № 2. Розв'язання експериментальних задач.
10. Короткі відомості з історії розвитку чорної металургії в Україні. Розв'язання задач на розрахунки за хімічними рівняннями за реагентами, що містять домішки.
11. Загальні способи одержання металів. Виробництво чавуну і сталі.
Лабораторний дослід 15. Ознайомлення зі зразками сплавів металів.
12. Охорона навколишнього середовища в металургійному виробництві й використання металів. Значення неорганічних сполук у природі, техніці й житті.
13. Узагальнюючий урок № 3 з теми «Металічні елементи та їхні сполуки».
Можливі теми рефератів:
1.Загальні властивості металів.
2.Розповсюдження лужних металів в природі та їх використання.
3.Розповсюдження лужноземельних металів і Магнію в природі та їх використання.
4.Корозія металів.
5.Твердість води.
6.Розповсюдження та використання Алюмінію та його сполук.
7.Розповсюдження та використання Заліза та його сполук.
8.Загальні способи одержання металів (чавун, сталь). Охорона навколишнього середовища в металургійному виробництві.
Проектна робота:
- 1.«Поняття про твердість води» – проблемне питання – вода та прання білизни.
Робота за планом:
- Пляма на одязі, та їх види.
- Методика виведення плям.
- Вплив твердої води на тканини.
- Microsoft PowerPoint pptx
- уроку Понікарова docx
ДНЗ «Мелітопольське вище професійне училище»

Конспект уроку з хімії
на тему:
«Поняття про твердість води. Використання найважливіших сполук Кальцію».
Розробив викладач
хімії та біології
спеціалист вищої категорії
Понікарова О.О.
2017
Методична розробка уроку на підтему:
«Поняття про твердість води. Використання найважливіших сполук Кальцію».
Підтема: «Поняття про твердість води. Використання найважливіших сполук Кальцію» входить до теми «Металеві елементи та їхні сполуки». Згідно з програмою на тему відводиться 13 годин.
Для вивчення теми виділені наступні підтеми:
- Положення металічних елементів у періодичній системі, особливості будови атомів. Металічний зв'язок.
- Фізичні властивості та застосування металів.
Лабораторний дослід 9. Ознайомлення зі зразками металів.
- Характерні хімічні властивості металів, корозія металів.
- Лужні метали. Натрій і Калій. Оксиди, гідроксиди, солі Натрію і Калію. Використання найважливіших сполук Натрію і Калію. Калійні добрива.
Лабораторний дослід 10. Ознайомлення зі зразками сполук Натрію і Калію.
- Лужноземельні метали і Магній. Кальцій. Кальцій оксид і гідроксид. Солі Кальцію.
Лабораторний дослід 11. Ознайомлення зі зразками сполук Кальцію і Магнію.
- Поняття про твердість води. Використання найважливіших сполук Кальцію.
Лабораторний дослід 12. Усунення накипу з поверхні побутових приладів.
- Алюміній. Алюміній оксид, гідроксид, їх амфотерність. Солі Алюмінію. Використання найважливіших сполук Алюмінію.
Лабораторний дослід 13. Добування Алюміній гідроксиду і доведення його амфотерності.
- Ферум. Залізо. Ферум (ІІ) і Ферум (ІІІ) оксиди, відповідні їм гідроксиди, їх амфотерність. Солі Феруму. Використання найважливіших сполук Феруму.
Лабораторний дослід 14. Добування Ферум (ІІ) та Ферум (ІІІ) гідроксидів реакцією обміну.
- Практична робота № 2. Розв’язання експериментальних задач.
- Короткі відомості з історії розвитку чорної металургії в Україні. Розв’язання задач на розрахунки за хімічними рівняннями за реагентами, що містять домішки.
- Загальні способи одержання металів. Виробництво чавуну і сталі.
Лабораторний дослід 15. Ознайомлення зі зразками сплавів металів.
- Охорона навколишнього середовища в металургійному виробництві й використання металів. Значення неорганічних сполук у природі, техніці й житті.
- Узагальнюючий урок № 3 з теми «Металічні елементи та їхні сполуки».
Можливі теми рефератів:
- Загальні властивості металів.
- Розповсюдження лужних металів в природі та їх використання.
- Розповсюдження лужноземельних металів і Магнію в природі та їх використання.
- Корозія металів.
- Твердість води.
- Розповсюдження та використання Алюмінію та його сполук.
- Розповсюдження та використання Заліза та його сполук.
- Загальні способи одержання металів (чавун, сталь). Охорона навколишнього середовища в металургійному виробництві.
Проектна робота:
- «Поняття про твердість води» – проблемне питання – вода та прання білизни.
Робота за планом:
- Пляма на одязі, та їх види.
- Методика виведення плям.
- Вплив твердої води на тканини.
Коротка характеристика теми:
Вивчення даної теми можливо проводити, спираючись на вже набуті у учнів знання про періодичний закон і систему хімічних елементів Д. І. Менделєєва, типи хімічних реакцій, загальні положення про кислоти, солі, луги, а також вже вивчених підтем: «Положення металічних елементів у періодичній системі, особливості будови атомів. Металічний зв'язок», «Фізичні властивості та застосування металів», «Характерні хімічні властивості металів, корозія металів», «Лужні метали. Натрій і Калій. Оксиди, гідроксиди, солі Натрію і Калію. Використання найважливіших сполук Натрію і Калію. Калійні добрива», «Лужноземельні метали і Магній. Кальцій. Кальцій оксид і гідроксид. Солі Кальцію», в точності: положення елементів в періодичній системі хімічних елементів, електронна будова атомів, валентність, ступінь окиснення, властивості металів, властивості карбонатної кислоти та карбонатів.
Тема. Поняття про твердість води. Використання найважливіших сполук Кальцію.
Мета:
- освітні: закріпити знання учнів про лужноземельні метали, їх положення в періодичній системі хімічних елементів Д.І. Менделєєва, властивості та біологічну роль; ознайомити учнів з поширеністю сполук кальцію і магнію в земній корі, з поняттями «якість води», «твердість води», навчити розрізняти типи твердості води, знати способи її пом’якшення та вміти застосовувати їх в повсякденному житті; актуалізувати знання про карбонові кислоти і карбонати.
- розвиваючі: розвивати пізнавальний інтерес до предмету, вміння самостійного пошуку та обробки інформації завдяки проектній діяльності, вміння складати рівняння хімічних реакцій; використовуючи міжпредметні зв’язки, розвивати вміння працювати з додатковим матеріалом, робити висновки і узагальнення, відстоювати власну думку.
- виховні: сприяти формуванню колективних і міжособистісних відносин; виховувати бережне ставлення до водних запасів.
Тип уроку: урок засвоєння нових знань, умінь та навичок і творче застосування їх на практиці.
Методи: усна та письмова перевірка знань, «хімічна розминка», робота з опорним конспектом, лекція, бесіда, демонстрація слайдів презентації, показ відеодослідів і анімації, демонстрація мильних розчинів води з різних міст України, лабораторний дослід, захист міні проектів, презентація буклету, «велике прання», «бліц-опитування», рефлексія, інструктаж.
Форма роботи: фронтальна, індивідуальна та групова; диференційована.
Обладнання: підручник, опорний конспект до уроку, періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності сполук у воді, мультимедійна установка, нетбук, наочний посібник «Гірські породи та мінерали», чайник з накипом, лимонна кислота, штатив з пробірками, колби з мильною водою з різних областей України, клаптики тканин з плямами, миски з м’якою та твердою водою, мило господарське, гумові рукавички, халат, мінеральна вода «Моршинська», «Миргородська», «Поляна квасова».
Базові поняття і терміни: сполуки Кальцію і Магнію: крейда, вапно, мармур, гіпс, фосфорит, апатит, доломіт, магнезит; прісна вода, контроль якості води, якісний та кількісний контроль води, мінеральна вода; твердість води, тимчасова, постійна та загальна твердість води.
Міжпредметні зв’язки: біологія, географія, екологія, матеріалознавство.
Девіз уроку: «Просто знати – це ще не все, знання варто використовувати» Йоганн Ґете.
Хід уроку.
І. Організаційний етап – слайд 1.
Вчитель: На минулому уроці ми вивчили лужноземельні метали. Відкрийте свої опорні конспекти, повторить основні питання теми.
ІІ. Актуалізація опорних знань: перевірка домашнього завдання – слайд 2.
Вчитель: Декілька учнів письмово виконають роботу на місцях та один учень доведе хімічні властивості металів, на прикладі Магнію.
Поки учні письмово працюють, ми починаємо «Хімічну розминку» з основних питань:
1. Порівняти будову атомів Калію і Натрію; Натрію і Магнію; Кальцію і Магнію (письмово декілька учнів).
+11Na 1s22s2p63s1
+19K 1s22s2p63s2p64s1
+12Mg 1s22s2p63s2
+20Са 1s22s2p63s2p64s2
2. Охарактеризуйте положення лужноземельних металів в періодичній системі хімічних елементів. Переличте ці метали.
Учні: ІІ група головна підгрупа періодичної системи хімічних елементів (Be, Mg) Ca, Sr, Ba, Ra.
3. Які фізичні властивості мають Кальцій і Магній?
Учні: Кальцій - метал сріблясто-білого кольору, дуже легкий, але твердіше лужних металів, більш висока температура плавлення 8510С.
Проста речовина магній - легкий, ковкий метал сріблясто-білого кольору. При звичайних умовах поверхню магнію покрита захисною плівкою оксиду магнію MgO, яка руйнується при нагріванні на повітрі до приблизно 600°C, після чого метал згоряє з сліпуче білим полум'ям. Температура плавлення металу 650°C.
4. Яка біологічна роль лужноземельних металів?
Учні: Іони Кальцію нормальна робота м'язів, згортання крові, скелет і зуби хребетних, тверді покриви ракоподібних черепах, молюск, корали. Містяться у всіх тканинах і рідинах організму людини. Іони Кальцію беруть участь в процесах згортання крові, регулюють найрізноманітніші внутрішньоклітинні процеси - м'язове скорочення, екзоцитоз, в тому числі секрецію гормонів і нейронів.
Магній міститься в тканинах тварин і рослин (хлорофіл), є учасником багатьох ферметатівних реакцій, необхідний при синтезі АТФ, бере участь у передачі нервових імпульсів, активно застосовується в медицині.
5. Хімічні властивості металів (письмово учениця біля дошки)
|
Метал (Магній) |
+ неметали (Сl2 або S) → + О2 → + Н2 → + Н2О → + кислота → |
Mg+Cl2→ MgCl2
Mg +S→ MgS
Mg +2HCl→ MgCl2+H2↑
Mg +2H2O→ Mg(OH)2+H2↑
Mg +H2→ MgH2
2Mg +O2→2MgO
(збір письмових робіт).
6. Чому лужноземельні метали мають таку назву?
Лужно - тому що розчини їх гідроксидів мильні на дотик, земельні - оксиди цих елементів вперше були виділені з мінералів земної кори.
ІІІ. Мотивація навчальної діяльності – слайд 3-4.
Вчитель:
Слайд 3. Вважають, що 70,8% поверхні земної кулі вкрито водою. Вода використовується в промисловості та техніці, в побуті, в сільському господарстві. Суттєвий вплив на властивості води спричиняють розчинені в ній речовини.
Слайд 4. Всім відомо, що мило добре піниться в дощовій воді, а якщо взяти воду з колодязя або ключову – то погано. Всі ми бачили у середині чайників накип. Це не дуже естетично, вода мутна, пити її неприємно.
Демонстрація чайника з накипом у середині.
Колообіг води у природі – показ анімації (1:07).
Які речовини потрапляють до води?
Як ці речовини впливають на властивості води?
Чи можна їх видалити з води?
Сьогодні на уроці ми про це і дізнаємось.
IV. Повідомлення теми, мети і плану уроку – слайд 5.
Тема сьогоднішнього уроку: «Поняття про твердість води. Використання найважливіших сполук Кальцію».
Метою нашого уроку є закріплення знань про лужноземельні метали; вивчення поширеності сполук кальцію і магнію в земній корі, ознайомлення з поняттями «якість води», «твердість води».
Працювати ми будемо як на минулих уроках з опорним конспектом, впродовж вивчення теми, ви будете заповнювати пробіли в тексті. А також ми сьогодні прослухаємо захист міні проектів і подивимось презентацію буклету, який випустили учениці по проблемному питання «вода та прання білизни».
План:
1. Поширеність сполук Кальцію в земній корі.
2. Поняття про якість води:
- контроль якості води
- мінеральна вода
3. Поняття про твердість (жорсткість) води:
- тимчасова
- постійна
- загальна
4. Вода та прання білизни.
5. Використання найважливіших сполук Кальцію.
V. Вивчення нового матеріалу – слайд 6.
Переходимо до вивчення нового матеріалу та перший пункт плану – Поширеність сполук Кальцію в земній корі.
Вчитель: – Чому Кальцій у чистому вигляді не трапляється в природі?
Учні: Кальцій активний метал, легко віддає 2 валентних електрони зовнішнього енергетичного рівня, зберігають його під шаром гасу, з яким він не реагує.
Вчитель: Я пропоную по черзі роздивитися наочний посібник «Гірські породи та мінерали» і записати формули сполук Кальцію в опорний конспект.
CaCO3 крейда, вапняк, мармур
CaSO4·2H2O гіпс
Ca3(PO4)2 фосфорит, апатит
CaCO3·MgCO3 доломіт
MgCO3 магнезіт
До якого класу неорганічних сполук належать сполуки Кальцію і Магнію?
Учні: солі.
2. Понятие про качество воды – слайд 7-8.
Слайд 7.
Вчитель: Жителі морів і океанів пристосувалися до життя в солоній воді, а ось наземним рослинам для живлення, людям і тваринам суші для пиття необхідна прісна вода - це вода з невеликим вмістом розчинених у ній речовин, які питну воду додають смак. Водопостачання жителів великих міст здійснюється водою річок і підземними водами. Перед тим як вода з'явиться в квартирах, її піддають очищенню і знешкодженню і постійно здійснюють контроль якості води.
Контроль якості води - виявлення відповідності складу питної води до встановленим санітарним нормам.
Існує документ - Національний стандарт України - Вода питна. Вимоги та методи контролю якості. На екрані ви бачите таблицю «Хімічні показники якості», де я виділила пункти: мінералізація, жорсткість, лужність води, вміст сульфатів і хлоридів, вміст Кальцію і Магнію.
У спеціальних лабораторіях фахівці проводять якісний і кількісний аналіз води на вміст в ній катіонів металевих елементів і водню, аніонів кислотних залишків, шкідливих мікроорганізмів, різних органічних речовин.
Переходимо до наступного слайду.
Зараз набули широкого застосування мінеральні води.
Слайд 8. Мінеральна вода - це узята з підземних джерел вода, яка містить розчинені речовини, корисні для організму людини.
Залежно від того скільки мінералів міститься в цій воді, вона буває столова, лікувальна і лікувально-столова.
Завдання учням: за написами на етикетках різних мінеральних вод з'ясуйте, які іони в них присутні і переважають в кількісному співвідношенні - запишіть ці іони в конспект.
(вчитель роздає три пляшки з мінеральною водою різних торгових марок на кожен ряд учням - 2-3 хвилини).
|
|
Миргородська |
Моршинська |
Поляна квасова |
|
Гідрокарбонати НСО3- |
150-450 |
30-200 |
4500-8000 |
|
Сульфати SO42- |
50-250 |
< 100 |
< 25 |
|
Хлориди Cl- |
1000-2500 |
< 60 |
300-600 |
|
Кальцій Ca2+ |
30-200 |
5-80 |
70-150 |
|
Магній Mg2+ |
< 50 |
< 50 |
< 50 |
|
Натрій і Калій Na+, K+ |
600-1200 |
< 70 |
1500-3000 |
За хімічним складом мінеральна вода буває гідрокарбонатна (більш ніж 600мг/л), хлоридна і сульфатна (більш ніж 200мг/л).
Висновок: «Миргородська» мінеральна вода – хлоридна, «Поляна квасова» - гідрокарбонатно-хлоридна, «Моршинська» - нормальна за показниками мінеральна вода.
Наступний пункт плану:
3. Поняття про твердість води (жорсткість) – слайд 9-14.
Слайд 9.
Вчитель: Якщо в складі питної та мінеральної води катіони Кальцію і Магнію є корисними, то для води, яку використовують в побуті, їх присутність небажана і в певній мірі шкідливо.
З присутністю в воді солей Кальцію і Магнію пов'язано поняття «твердість води».
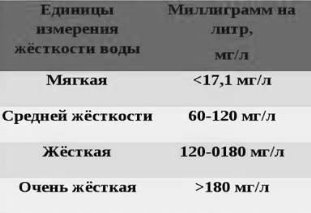
Вода, 1л якої містить до 17 мг іонів Кальцію і Магнію, вважається м'якою. Вода з вмістом понад 120 мг / л іонів Кальцію і Магнію називається твердої.
Прикладом м'якої води є дощова, твердої - вода морів і океанів.
Демонстрація таблиці «Класифікація води по жорсткості»
Слайд 10.
Вчитель: пропоную прослухати захист міні проектів учнів - «Де не можна використовувати тверду воду?» Тверду воду не можна використовувати ...
• для прання білизни, фарбування тканин;
• в паперовій, шкіряній, крохмальної, спиртовий промисловістях;
• при приготуванні їжі - овочі і м'ясо погано розварюються;
• для пиття теж не придатна *
• при кип'ятінні твердої води утворюються накип, яка погано проводить тепло, тим самим підвищує витрати, призводить до руйнування стінок котлів, що може привести до аварії.
Вчитель: Розрізняють тимчасову, постійну та загальну твердість води.
Слайд 11. Тимчасова твердість води.
Вчитель: Твердість води, обумовлена вмістом у ній кальцій гідрокарбонату і магній гідрокарбонату, отримала назву тимчасова, або карбонатна.
Завдання учням: запишіть формули солей, які обумовлюють тимчасову твердість води.
Ca(HCO3)2 Mg(HCO3)2
Пропоную вам переглянути відеоопит «Пом'якшення води з тимчасової жорсткістю - кип'ятіння» (0:18).
- Вам відомо з тем карбонатна кислота і карбонати, що гідрокарбонати при нагріванні перетворюються в карбонати - нерозчинні солі, які утворюють накип усередині побутових приладів.
Запишіть рівняння реакції: Ca(HCO3)2 t→ CaCO3↓ + H2O + CO2↑
- крім кип'ятіння, тимчасову твердість видаляють хімічним шляхом, додаючи в воду соду Na2CO3
Запишіть рівняння реакції: Ca(HCO3)2 + Na2CO3 → CaCO3↓ + 2NaHCO3
Слайд 12. Постійна твердість води.
Вчитель: Крім солей карбонатної кислоти, в воді можуть бути і солі хлоридної і сульфатної кислоти, які не можна видалити з води кип'ятінням.
Твердість води, обумовлена вмістом у ній сульфатів і хлоридів Кальцію і Магнію, отримала назву постійна, або некарбонатна.
Завдання учням: запишіть формули солей, які обумовлюють постійну твердість води.
CaSO4 MgSO4 СaCl2 MgCl2
Вчитель: Постійну твердість води видаляють хімічними способами, використовуючи речовини, які переводять іони Кальцію і Магнію з розчину в практично нерозчинні сполуки.
Пропоную вам подивитися ще один відеоопит «Пом'якшення води з постійною твердістю - додавання соди» (0:20).
- Як і в випадку з тимчасової твердістю, при додаванні в воду соди, утворюється нерозчинний карбонат. Цей спосіб отримав назву - содовий метод.
Запишіть рівняння реакції: CaSO4 + Na2CO3 → CaCO3↓+ Na2SO4
MgCl2 + Na2CO3 → MgCO3↓+ 2NaCl
- ще один спосіб пом'якшення води - це фосфатний. Розчинні солі фосфатної кислоти, фосфат-іони з іонами Кальцію і Магнію утворюють нерозчинні сполуки.
Запишіть рівняння реакції: 3CaSO4 + 2Na3PO4 → Ca3(PO4)2↓ + 3Na2SO4
3MgCl2 + 2Na3PO4 → Mg3(PO4)2↓+ 6NaCl
Слайд 13. Табл. «Ионообменная колонка».
Вчитель:
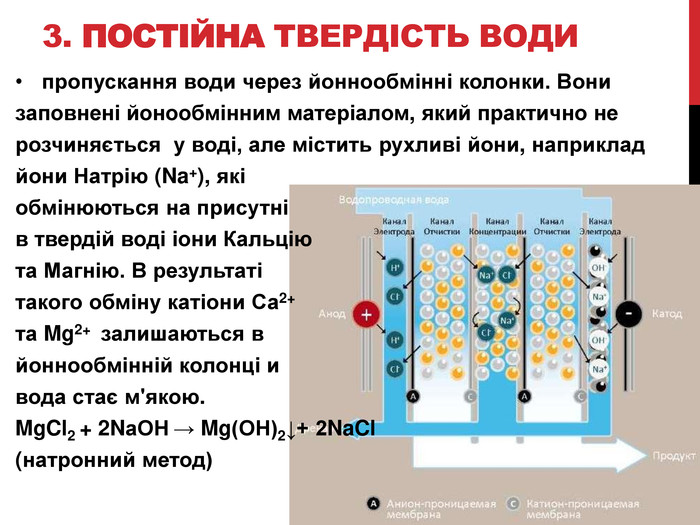
- Перспективним і ефективним способом пом'якшення води з постійною твердістю є натронний метод, при якому воду пропускають через іонообмінні колонки. Вони заповнені іонообмінним матеріалом, який практично не розчиняється у воді, але містить рухливі іони, наприклад іони натрію (Na+), які обмінюються на присутні в твердій воді іони Кальцію і Магнію. В результаті такого обміну катіони Са2+ і Mg2+ залишаються в іонно-обмінній колонці і вода стає м'якою.
Запишіть рівняння реакції: MgCl2 + 2NаОН → Mg(ОН)2↓+ 2NaCl
Слайд 14.
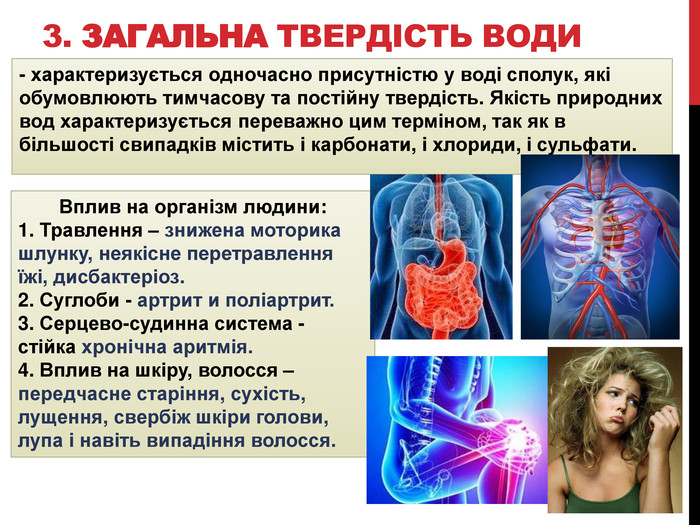
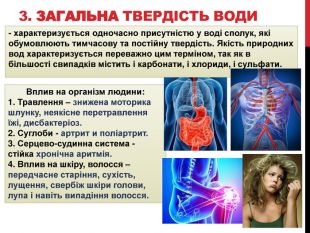
Вчитель: терміном загальна твердість води - характеризується одночасно присутністю в воді сполук, які зумовлюють тимчасову і постійну твердість. Якість природних вод характеризується переважно цим терміном, тому що в більшості випадків містить і карбонати, і хлориди, і сульфати.
Пропоную прослухати захист ще проекту – «Як впливає постійне використання жорсткої води на організм людини».
- Солі жорсткої води, потрапляючи в організм, з'єднуються з білками. Утворилися в результаті такої реакції речовини осідають на стінки шлунку і стравоходу, покриваючи його стійкою плівкою. Це ускладнює процес перистальтики, порушується робота ферментів. Підсумок - знижена моторика шлунку, неякісне перетравлення їжі, дисбактеріоз.
- Деякі солі, що потрапляють в організм з жорсткою водою, утворюють неорганічні сполуки, які поступово витісняють з суглобів синовіальну рідину. Підсумок - артрит і поліартрит.
- Жорстка вода згубно впливає і на серцево-судинну систему - виникнення стійкої хронічної аритмії.
- Вплив на шкіру, волосся - передчасне старіння, сухість, лущення, свербіж шкіри голови, лупа і навіть випадання волосся.
4. Вода и прання білизни – слайд 15-17.
Слайд 15.
Вчитель: Перед тим, як ми перейдемо до 4 пункту плану - вода і прання білизни, пропоную переглянути відеодослід «Що заважає милу милитися?» (1:37).
Слайд 16.
Вчитель: Знайомлячись в 9 класі з важливими органічними сполуками, ви дізналися, що мило С17Н35СООNа (стеарат натрію) є натрієвої сіллю органічної стеаринової кислоти. Як і всі сполуки Натрію, мило добре розчиняється в воді і в розчиненому вигляді проявляє миючу дію. Але через наявність у воді іонів Кальцію і Магнію мило вступає в реакцію обміну з утворенням нерозчинних сполук Кальцію і Магнію.
Демонстрація пробірок з мильною водою з різних міст України (Кривий Ріг, Дніпро, Львів, Мелітополь).
Кальцій стеарат і є «пластівці», які ми бачимо на поверхні твердої води, коли пробуємо прати в ній речі милою. До тих пір, поки катіони Кальцію і Магнію НЕ будуть переведені в нерозчинний стан, миючий дію проявляється слабо.
Запишіть рівняння реакції:
2С17Н35СООNа + CaSO4 → Са(С17Н35СОО)2↓+ Nа2SO4
Пропоную прослухати захист проекту «Вода і прання білизни».
Учні розробили буклет, де вирішували проблемне питання. Роботу вони проводили за планом: плями на одязі, їх види; методика виведення плям; вплив жорсткої води на тканини.
У той час поки йде захист проекту, учениці проведуть «велике прання» (демонстраційний досвід) забруднених клапотів тканини в м'якій і твердій воді.
Доповідь учнів – «вплив твердої води на тканини».
Багато мила витрачається непродуктивно. Ці «пластівці» - стеарати Кальцію або Магнію, разом із забрудненнями залишається на тканині, надаючи їй сірий або жовтуватий колір. Білизна робиться крихким, липким, втрачає міцність. Погіршуються і її гігієнічні властивості: пористість, повітропроникність, гігроскопічність (вбирання води і поту) та інше. Крім того, білизна швидше забруднюється і важче відпирається, а також швидше зношується, тому що опади сприяють стиранню тканини. Пофарбовані речі набувають блідий негарний відтінок. При полосканні в жорсткій воді залишився на білизну мило утворює осад, що не змивається з білизни і погіршує його якість. Вовняні і шовкові речі від жорсткої води більше сідають при пранні, втрачають м'якість, блиск і також швидше зношуються.
Найменш придатною для прання є вода, що містить солі заліза. При пранні залізо у вигляді іржі осідає на білизну і поступово руйнує тканину.
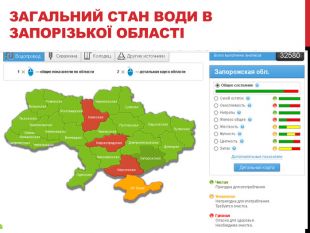
Слайд 17. Загальний стан води в Запорізькій області – демонстрація скріншоту сторінки сайту.
Учні: Висновок після виведення бруду з клапотів тканин: в твердій воді дійсно багато утворилося «пластівців», бруд гірше вивівся з тканини.
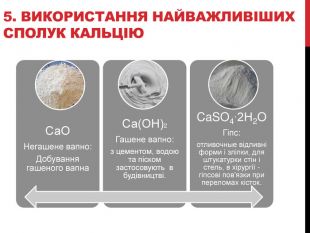
5. Використання найважливіших сполук Кальцію – слайд 18.
Вчитель:
Переходимо до останнього пункту плану. Найбільш важливими сполуками Кальцію є СаО негашене вапно, Са(ОН)2 гашене вапно і CaSO4 ∙ 2H2O гіпс. Негашене вапно переробляють на гашене. Гашене вапно з цементом, водою і піском застосовується в будівництві. Гіпс використовують для відливання форм і зліпків, для штукатурки стін і стель, в хірургії як гіпсові пов'язки при переломах кісток.
VI. Узагальнення і систематизація знань - закріплення - слайд 19.
Вчитель: пропоную провести "Бліц опитування".
1. Солі яких металів обумовлюють твердість води?
Кальцію і магнію
2. Які види твердості води вам відомі?
Тимчасова (карбонатна), постійна (некарбонатна) і загальна твердість води.
3. Якої шкоди приносить тверда вода?
VII. Рефлексія
Слайд 20.
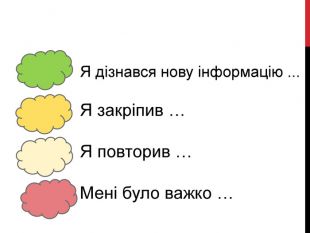
Вчитель: пропоную вибрати речення, яке ви хотіли б закінчити.
Я дізналася нову інформацію ...
Я закріпила ...
Я повторила ...
Мені було складно ...
Біля цих пропозицій ви бачите кольорові плями, вклейте їх собі в опорний конспект.
VIII. Домашнє завдання:
Слайд 21
• § 20, завдання 1-3 стор. 171
• Провести лабораторний експеримент «Усунення накипу з поверхні побутових приладів».
Вклеєні плями мають свої позначення:
плями від чаю і кави,
пляма від молока,
пляма від бруду,
пляма від трави.
• Провести експеримент з виведенням плям з одягу (користуючись буклетом).
Початок уроку.

Перевірка домашнього завдання. Хімічні властивості металів.
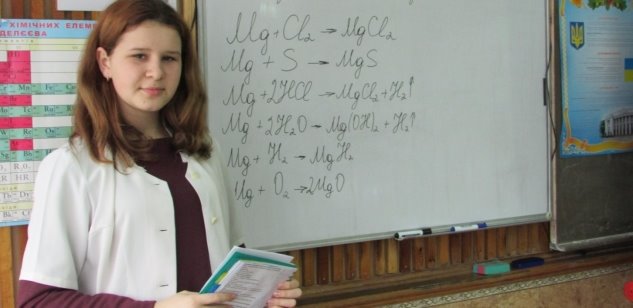
Вивчення нового матеріалу.
Перегляд наочного посібника «Гірські породи та мінерали» і запис формул сполук Кальцію в опорний конспект.

Завдання учням: за написами на етикетках різних мінеральних вод з'ясуйте, які іони в них присутні і переважають в кількісному співвідношенні - запишіть ці іони в конспект.

Поки йде захист проекту «Вода та прання білизни», учениці проведуть «велике прання» (демонстраційний досвід) забруднених клапотів тканини в м'якій і твердій воді.

Висновок після виведення бруду з клапотів тканин: в твердій воді дійсно багато утворилося «пластівців», бруд гірше вивівся з тканини.

-
Дякую!


про публікацію авторської розробки
Додати розробку