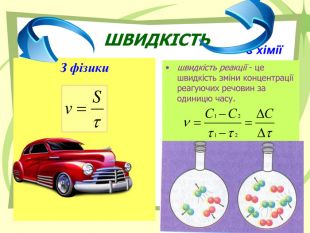
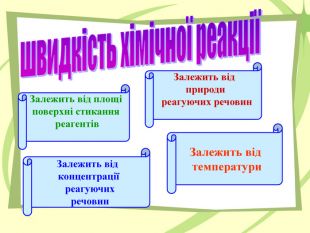
Презентація до уроку на тему "Швидкість хімічних реакцій"
Про матеріал
Презентація до уроку на тему "Швидкість хімічних реакцій" для учнів 9 класу. До презентації ждодається розробка уроку Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Перепрошую, але у самостійній роботі відповідь на сьоме питання викликає сумніви - швидкість псування харчових продуктів з підищенням температури залежить від швидкості розмноження бактерій, і це скоріше біологічна причина, а не хімічна.
-


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку