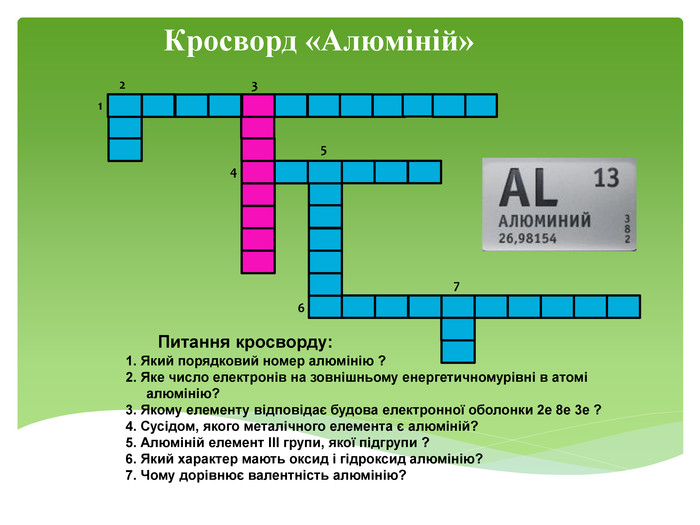
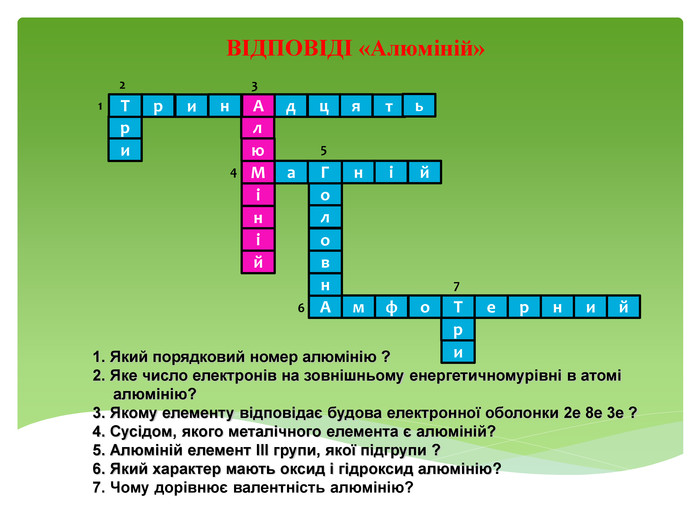
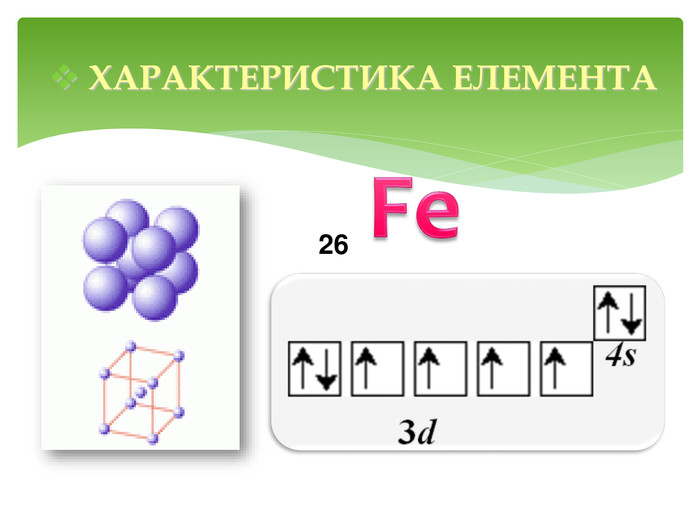
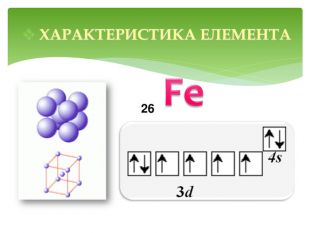
Презентація до уроку "Ферум як представник металічних елементів"
Про матеріал
Презентація до уроку "Ферум як представник металічних елементів". Демонстраційні слайди презентації може використовувати викладач під час проведення уроку.
Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку