Презентація до уроку в 11 класі "Узагальнення знань з теми " Хімічні рівняння"

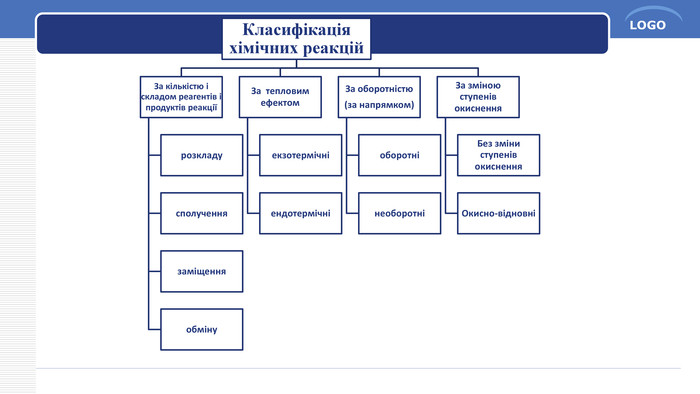
























Оборотні і необоротні реакції1. Які реакції називаються необоротними?Необоротними називаються хімічні реакції, що відбуваються в одному напрямку до повного перетворення вихідних речовин у продукти реакції.2. У яких випадках хімічні реакції є необоротними? 1. Один із продуктів, що утворюється, виходить зі сфери реакції – випадає у осад або виділяється у вигляді газу. Ва. Сl2 + H2 SO4 → Ba. SO4↓ + 2 HCl. Ca. CO3 + 2 HCl → Ca. Cl2 + H2 O + CO2↑2. Утворюється малодисоційована сполука (наприклад, вода). H2 SO4 + 2 Na. OH → Na2 SO4 + 2 H2 O3. Реакція супроводжується виділенням великої кількості енергії. С + О2 → СО2 + Q
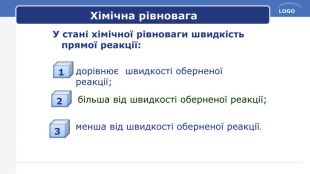
Хімічна рівновага. Хімічна рівновага – такий стан оборотної реакції, коли швидкість прямой реакції дорівнює швидкості зворотної. Стан хімічної рівноваги: скільки частинок вихідних речовин вступає в пряму реакцію, стільки саме їх утворюється в результаті зворотної реакції, тобто концентрації речовин залишаються незмінними. Що називається хімічною рівновагою?
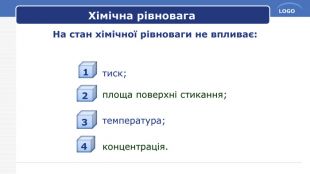
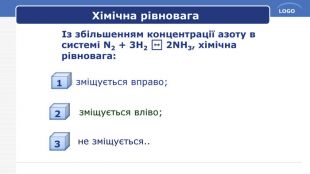
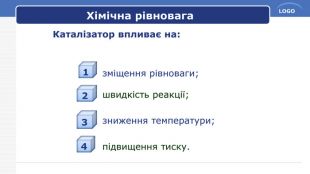
Принцип Ле Шательє. Сформулюйте загальний принцип зміщення хімічної рівноваги, який названий на честь Ле Шательє. Принцип Ле Шательє: Якщо на систему в стані хімічної рівноваги чинити якусь дію (змінити тиск, температуру, концентрацію речовин), то рівновага зміщується в бік той реакції, яка послаблює цю дію.
Принцип Ле Шательє Позначте правильне твердження щодо принципу Ле Шательє (натисніть на кубик):підвищення тиску в рівноважній системі зміщує рівновагу в бік збільшення сумарного об’єму;підвищення температури в рівноважній системі зміщує рівновагу в бік екзотермічної реакції; збільшення концентрації однієї з речовин у рівноважній системі зміщує рівновагу в такий спосіб, щоб її концентрація ще додатково збільшилася.14збільшення концентрації однієї з речовин у рівноважній системі зміщує рівновагу в такий спосіб, щоб максимально її витратити;32
Хімічна рівновага. Позначте правильне твердження щодо хімічної рівноваги:після встановлення хімічної рівноваги реакція зупиняється;якщо система перебуває в рівноважному стані, концентрація речовин не змінюється; стан хімічної рівноваги неможливо порушити жодними чинниками.124хімічна рівновага настає тільки в необоротних реакціях;3
Застосуємо свої знання. Вибрати, у який бік зміститься рівновага реакції 2 SO2(г) + О2 (г) ↔ 2 SO3 (г) + 284,2 к. Дж 1. В разі підвищення температури.2. При підвищенні концентрації SO2.3. При підвищенні тиску. Відповіді:1. У бік вихідних речовин, вліво.2. У бік продуктів реакції, вправо.3. У бік продуктів реакції, вправо.
У яких випадках відбувається гідроліз солей?1. Гідроліз солей, що утворені сильною основою і слабкою кислотою, наприклад, Na2 CO3 (гідроліз за аніоном).2. Гідроліз солей, що утворені слабкою основою і сильною кислотою, наприклад, Fe. Cl3 (гідроліз за катіоном).3. Гідроліз солей, що утворені слабкою основою і слабкою кислотою, наприклад, СН3 СООNH4 (гідроліз за катіоном і за аніоном)Гідроліз
Увага!Гідроліз солей, що утворені сильною основою і сильною кислотою не відбувається. Наприклад, КCl, Na2 SO4, Ca(NO3)2 Йони таких солей¯ не утворюють з водою слабких електролітів. Рівновага дисоціації води не порушується. Реакція розчину залишається нейтральною, і гідроліз практично не відбувається (р. Н = 7).
Застосуйте свої знання. Знайти відповідність між речовиною, середовищем та значенням р. Н при гідролізі: 1) Ba(NO3)2; А) кислотне; а) р. Н ˃ 72) Fe. SO4; Б) лужне; б) р. Н ˂ 73) K2 CO3 В) нейтральне; в) р. Н = 74) Li2 SO4;5) Cu. Cl2;6) K2 S. Відповіді: 1 Вв, 2 Аб, 3 Ба, 4 Вв, 5 Аб, 6 Ба.

про публікацію авторської розробки
Додати розробку























-

Колесник Наталія Іванівна
28.11.2024 в 21:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бєля Оксана Вікторівна
05.05.2024 в 18:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Єщенко Наталія Анатоліївна
01.12.2023 в 12:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кисла Світлана Дмитрівна
04.12.2022 в 20:37
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крамар Світлана
14.11.2022 в 22:08
чудова робота, дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Онишко Ольга Олександрівна
10.11.2021 в 07:34
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Паращак Наталія Миколаївна
20.04.2021 в 11:43
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 4 відгука