Презентація "Добування металів. Електроліз. Металотермія"
Про матеріал
Для використання на уроках хімії з метою ознайомлення з хімічними виробництвами Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


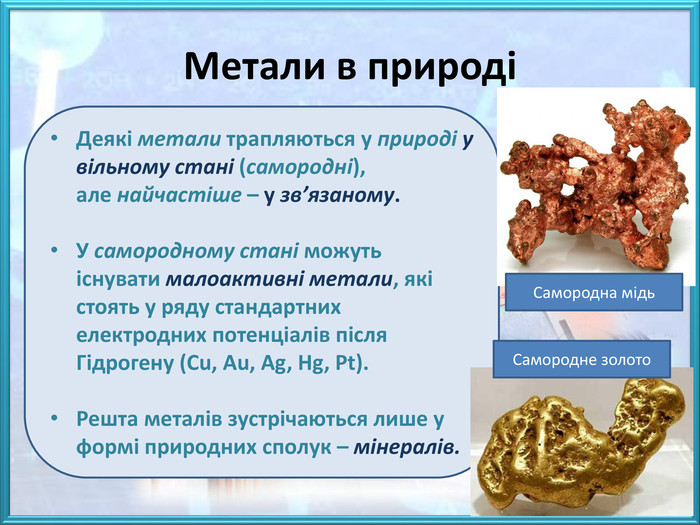
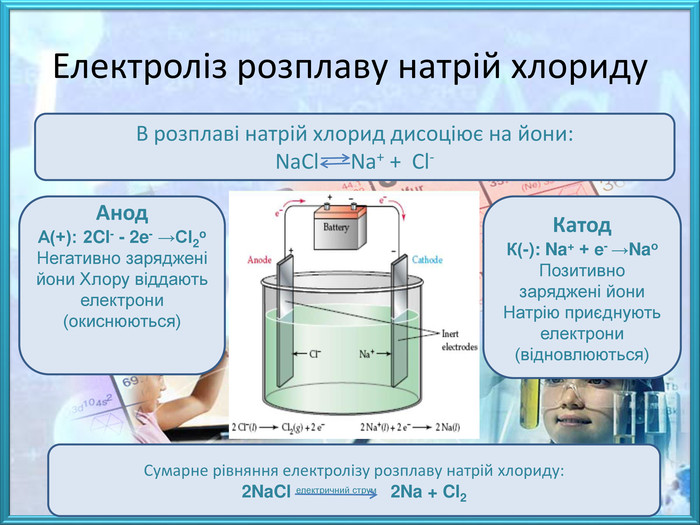
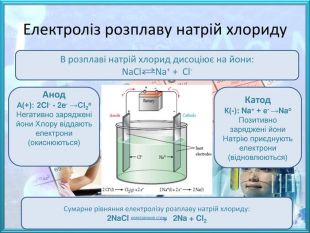
![Природні сполуки металів, з яких технологічно можливо та економічнодоцільно добувати метал називають рудами, до їх складу, крім корисного мінералу входить пуста порода. Залежно від складу основного мінералу, розрізняють руди:- оксидні – Cu2 O (куприт), Fe2 O3 (гематит), Al2 O3 (корунд);- сульфідні – Fe. S2 (пірит), мідний блиск (Cu2 S), кіновар (Hg. S);- хлоридні – сильвініт (KCl∙Na. Cl), карналіт (KCl∙Mg. Cl2∙6 H2 O);- карбонатні – кальцит (Ca. CO3), малахіт ([Cu. OH]2 CO3), магнезит (Mg. CO3). Малахіт. Сильвініт Природні сполуки металів, з яких технологічно можливо та економічнодоцільно добувати метал називають рудами, до їх складу, крім корисного мінералу входить пуста порода. Залежно від складу основного мінералу, розрізняють руди:- оксидні – Cu2 O (куприт), Fe2 O3 (гематит), Al2 O3 (корунд);- сульфідні – Fe. S2 (пірит), мідний блиск (Cu2 S), кіновар (Hg. S);- хлоридні – сильвініт (KCl∙Na. Cl), карналіт (KCl∙Mg. Cl2∙6 H2 O);- карбонатні – кальцит (Ca. CO3), малахіт ([Cu. OH]2 CO3), магнезит (Mg. CO3). Малахіт. Сильвініт](/uploads/files/474111/259709/281462_images/3.jpg)