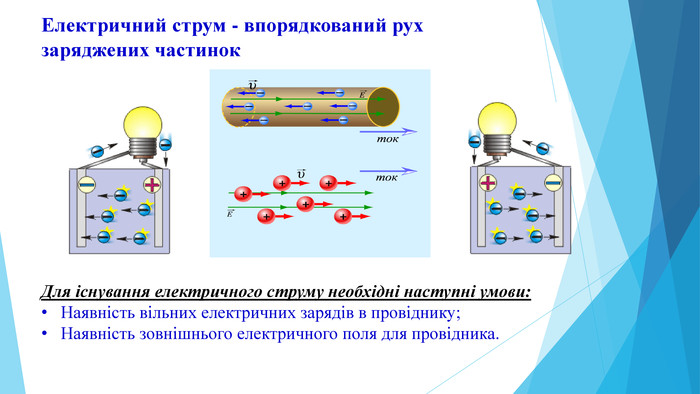
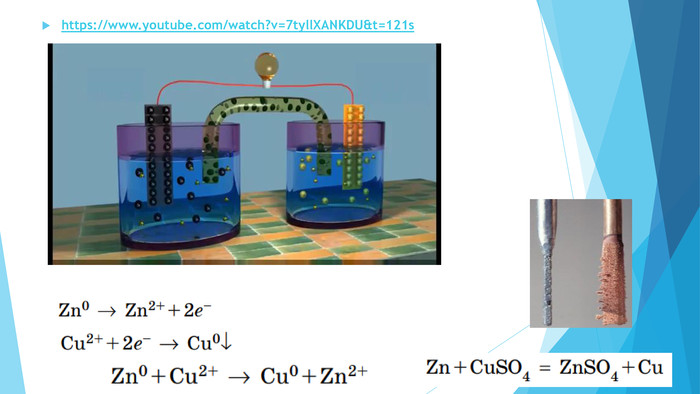
Презентація "Поняття про гальванічний елемент як хімічне джерело електричного струму "
Про матеріал
Презентація до уроку хімії в 11 класі "Поняття про гальванічний елемент як хімічне джерело електричного струму" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку