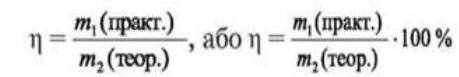Задачі. Відносний вихід продукту реакції
11 клас
РОЗРАХУНКОВІ ЗАДАЧІ.
ОБЧИСЛЕННЯ ЗА ХІМІЧНИМ РІВНЯННЯМ, ПОВЯЗАНІ З МАСОВОЮ (ОБЄМНОЮ) ЧАСТКОЮ ВИХОДУ ПРОДУКТУ РЕАКЦІЇ
Розрахунки за хімічними рівняннями справедливі, якщо в реакцію вступають абсолютно чисті речовини та їх взаємодія протікає без втрат. Однак реальна кількість продукту не відповідає розрахованій: вона завжди менша. Розрізняють практичний і теоретичний вихід продукту.
Практичний вихід – це маса, або об’єм продукту, який отримують в процесі виробництва або лабораторних дослідженнях.
Теоретичний вихід – це маса, або об’єм продукту, який можна було б отримати згідно з розрахунками за рівнянням хімічних реакцій.
Відношення маси практичного виходу до маси теоретичного виходу називається масовою часткою виходу продукту
Вихід продукту обчислюється за формулами:
ω = ![]() 100% - масова частка виходу
100% - масова частка виходу
φ = ![]() 100% - об’ємна частка виходу
100% - об’ємна частка виходу
вихід продукту може бути виражений в частках одиниці або відсотках.
У розрахункових задачах з хімії потрібно або врахувати практичний вихід продукту реакції, або знайти його.
АЛГОРИТМ РОЗВ ЯЗУВАННЯ ЗАДАЧ
1. Уважно читаємо умову задачі і записуємо Дано та що потрібно знайти.
2. Записуємо рівняння реакції та не забуваємо про коефіцієнти.
3. Вносимо у рівняння, ті значення величин, що у нас дано в умові задачі. Над речовиною значення величини котрої потрібно знайти ставимо - х. (над формулами),
4. Обов'язково буде речовина, для якої дано масу (або об'єм) та все ж треба буде знайти ще раз масу (або об'єм). Це тому, що нам потрібно знайти теоретичну величину, а в умові задачі завжди дана практична величина (маса, об'єм, чи навіть кількість речовини).
5. Наше подальше завдання знайти величину х, тому на даному етапі ми практичну величину (поки-що) не враховуємо.
6. Щоб скласти пропорцію виконуємо ті ж дії, що і в інших типах задач - шукаємо величини, що можна поставити під формулами у рівнянні
6.1. Якщо в задачі дано маси речовин - знаходимо їх молярні маси і переводимо в звичайні маси, враховуючи коефіцієнти
Наприклад, n(H2O) = m(H2O)/ М(H2O),
звідси m(H2O) = n(H2O) * М(H2O)
2. Теж саме виконуємо, якщо дано об'єм - переводимо молярний об'єм в звичайний об'єм
Наприклад, n(H2O) = V(H2O)/ Vm(H2O)
звідси V(H2O) = n(H2O) * Vm(H2O)
n - це коефіцієнт, що стоїть перед формулою у рівнянні реакції. (кількість речовини)
7. Складаємо пропорцію і обраховуємо значення х.
8. Увага, задача ще не розв'язана - ми знайшли лише теоретичну величину. Тепер потрібно знайти вихід продукту за формулою
Приклади задач
1.Обчисліть об’єм амоніаку(н.у.), який можна одержати з азоту об’ємом 0,68 л і достатньої кількості водню, якщо вихід амоніаку становить 43 %.

2. Розрахувати масу негашеного вапна (кальцій оксид, що утвориться в результаті випалювання 1200г кальцій карбонату, якщо вихід продукту дорівнює 75%
![]() Дано: розв’язання:
Дано: розв’язання:
m (СаСО3)= 1200г записуємо рівняння реакції:
![]() ω =75% = 0,75 1200г хг
ω =75% = 0,75 1200г хг
Знайти: СаСО3 = СаО +СО2
m (СаО) = ? 1 моль 1 моль
100г/моль 56 г/моль
100г 56г х= 672г
Знайдена маса – теоретична, тобто це маса, кальцій оксиду, яку б можна було добути за умови 100% виходу продукту реакції. Розраховують практичну масу кальцій оксиду:
mпрак (СаО) = 0,75 * 672 = 504г
Відповідь: маса негашеного вапна, яку можна добути, 504г.
Задачі для самостійного розв’язку:
- Аміак масою 34 кг пропустили через розчин сульфатної кислоти. Масова частка виходу амоній сульфату дорівнює 90%. Обчислити масу добутого амоній сульфату. (118,8кг)
- При нагріванні калій нітрату масою 30,3гзібрали 3л кисню. Обчисліть обємну частку виходу. (89,2%)
- З азоту масою 56кг було синтезовано аміак масою 48 кг. Знайдіть масову частку виходу аміаку від теоретично можливого.
- У результаті розчинення у сульфатній кислоті цинку масою 1,3 г добули водень об’ємом 0,4л (н.у.). обчисліть вихід водню.
- Яку масу сульфур (УІ) оксиду можна добути із 32г сульфур (ІУ) оксиду, якщо вихід реакції становить 95%.
- Який об’єм аміаку можна синтезувати з азоту масою 112 кг, якщо об’ємна частка виходу аміаку становить90% від теоретичного.
- Визначити вихід ферум (ІІ) сульфіду, якщо із заліза масою 150г в реакції з сіркою добули ферум (ІІ) сульфід масою 120г.
- Яку масу сірки спалили, якщо добуто 762 кг сульфур (ІУ) оксиду, а масова частка виходу становить 80%.
- Який об’єм водню витратиться на добування аміаку масою 70г, що становить 78% від теоретичного.
- Унаслідок взаємодії натрій нітрату із сульфатною кислотою одержали 2,7 г нітратної кислоти, що становить 90% від теоретично можливого. Скільки натрій нітрату вступило в реакцію.
- Яку масу сірководню спалили, якщо об’єм добутого сірчистого газу 13,44л (н.у.). вихід газу становить 80%
-
-
-
дякую


про публікацію авторської розробки
Додати розробку