Презентація "Електронні і графічні електронні формули атомів s-, p-, d-елементів. Принцип "мінімальної енергії".
Про матеріал
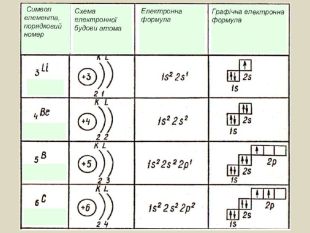
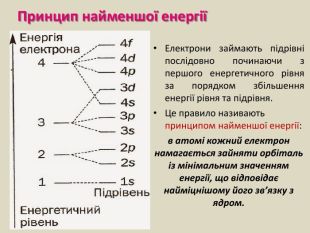
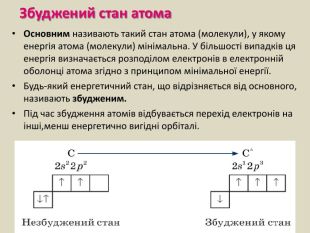
Презентація до уроку хімії в 11 класі з теми "Електронні і графічні електронні формули атомів s-, p-, d-елементів. Принцип "мінімальної енергії". Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




















-

Кузьменко Ольга Сергіївна
17.12.2024 в 14:37
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Потапова Галина Іванівна
19.09.2024 в 23:10
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Головатюк Лілія Євгеніївна
15.09.2024 в 18:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крамар Світлана
11.09.2023 в 22:30
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Медведчук Тетяна
07.09.2023 в 14:05
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лобач Маргарита Іванівна
06.11.2022 в 09:44
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука