Презентація " Фізичні властивості кислот"
Про матеріал
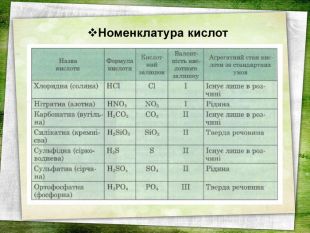
Презентація " Фізичні властивості кислот" розроблена для учнів 8 класу. Унаочнює матеріал, який вивчається, пропонуються кросворд, мозковий штурм, чайнворд та інші форми та методи роботи. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку