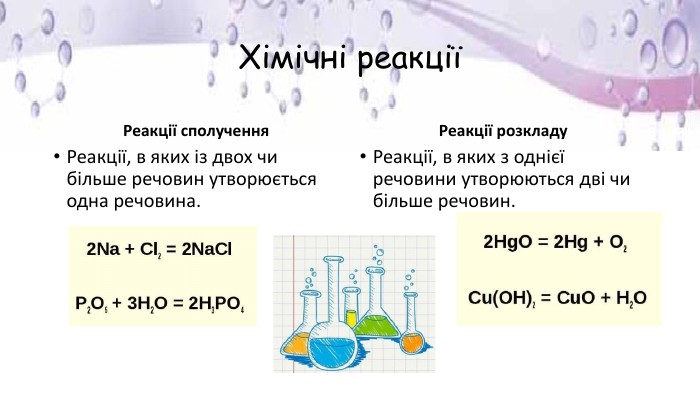
Презентація "Фізичні й хімічні явища. Рівняння хімічних реакцій"
Про матеріал
Презентація "Фізичні й хімічні явища. Рівняння хімічних реакцій" створена для супроводу дистанційного навчання з Хімії 8 клас за підручником О.Г. Ярошенко. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку