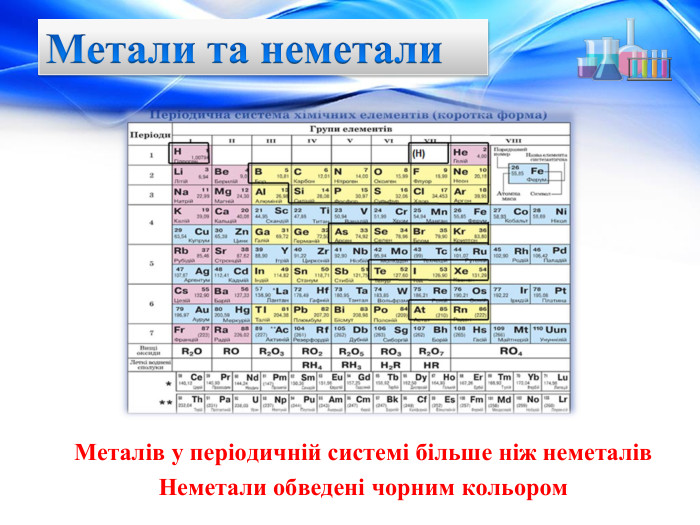
Презентація "Характеристика хімічних елементів № 1-20 за їхнім місцем у періодичній системі та будовою атома"











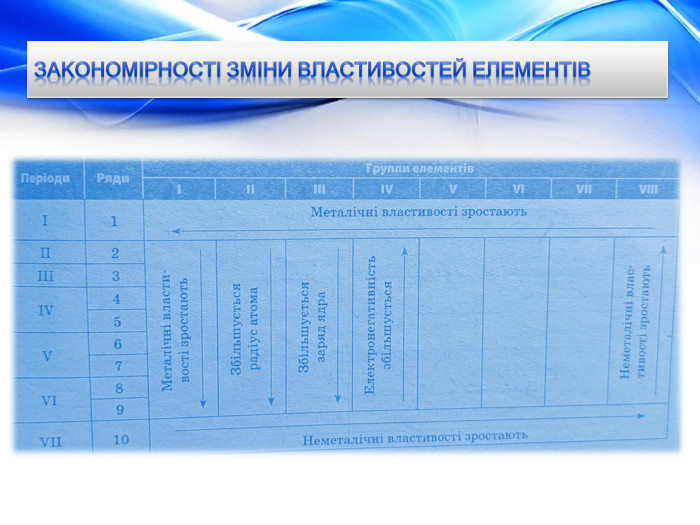


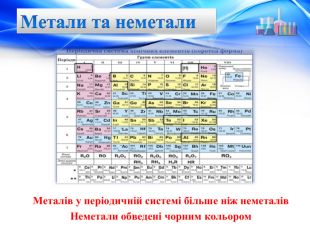
Радіус атома. Електрони рухаються хвилеподібно, форма орбіталей різна, тому радіус атома визначається експериментально. Одиницею вимірювання атомних радіусів є нанометр (нм): 1 нм = 1 * 10-9 м. Зміна радіусів атомів в групах. Радіус атома визначається числом енергетичних рівнів в ньому. Чим більше рівнів заповнено електронами, тим більше радіус атома. Згадаємо будову електронних оболонок елементів IA та IIA груп: Зі збільшенням порядкового номера в групі радіуси атомів збільшуються. У кожній групі найбільші радіуси у елементів сьомого періоду. Зміна радіусів атомів в періодах. В елементах одного періоду число енергетичних рівнів в атомах є однаковим. Збільшуються заряд ядра і число зовнішніх електронів. Зовнішні електрони все сильніше притягуються до позитивно зарядженого ядра, атоми стискаються, і за рахунок цього їх радіуси зменшуються. Найбільші радіуси в кожному періоді — в елементах IA групи (у лужних металів).
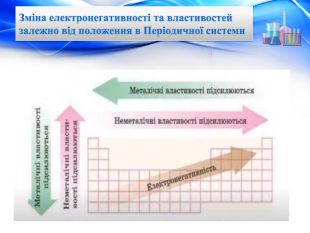
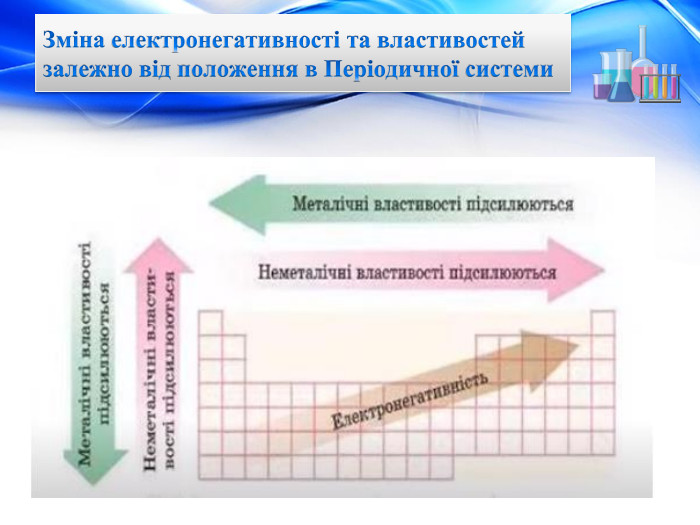
Електронегативність Зміна електронегативності у Періодичній системіЗі збільшенням порядкового номера елементів ЕН змінюється періодично. У періоді вона зростає зліва направо при накопиченні електронів на зовнішньому шарі. У групі вона знижується згори донизу при збільшенні числа електронних шарів і збільшенні атомних радіусів. Найбільшу ЕН у кожному періоді мають найменші атоми, які мають сім зовнішніх електронів — атоми галогенів (інертні гази сполук не утворюють). Найменшу ЕН у періоді має найбільший атом з одним зовнішнім електроном — атом лужного елемента. Електронегативність елемента – це умовне значення атома, що характеризується здатністю притягувати до себе електрони під час утворення хімічних зв’язків. Ця здатність змінюється в періодах і групах залежно від розміщення елемента в періодичній системі.
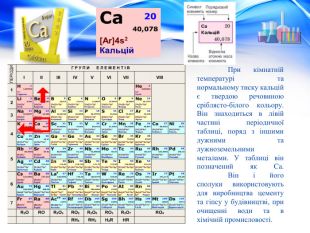
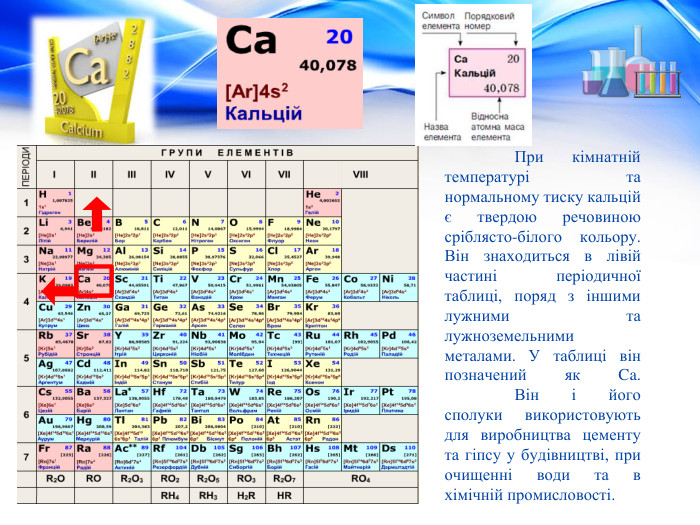
При кімнатній температурі та нормальному тиску кальцій є твердою речовиною сріблясто-білого кольору. Він знаходиться в лівій частині періодичної таблиці, поряд з іншими лужними та лужноземельними металами. У таблиці він позначений як Ca. Він і його сполуки використовують для виробництва цементу та гіпсу у будівництві, при очищенні води та в хімічній промисловості.
Цікаві факти про кальцій1. Кальцій зустрічається в багатьох породах, таких як вапняк, крейда і мармур, а також в багатьох молочних продуктах та овочах. 2. Кальцій є хімічним елементом з символом Са та атомним номером 20. 3. Назва кальцію походить від латинського слова calx, що означає лайм. 4. Зі всіх елементів у земній корі кальцій є п’ятим за чисельністю. Це становить трохи більше 3% грунту, повітря та океанів. 5. Кальція природно немає у його елементарному стані, але сполуки кальцію звичайні. 6. Сполуки кальцію найчастіше зустрічаються в осадових породах, таких як вапняк, крейда і мармур, в яких присутні карбонатні мінерали кальцію, такі як кальцит і доломіт. Ознайомтеся з нашими фактами про карбонат кальцію для отримання додаткової інформації. 7. Кальцій зустрічається також в інших мінералах, таких як гіпс (сульфат кальцію) і флюорит (фторид кальцію), і він зустрічається меншою мірою у вивержених та метаморфічних породах, головним чином силікатних мінералах. 8. Елемент має бути витягнутий за допомогою електролізу. Після очищення до м’якого сріблясто-білого металу кальцій реагує, він швидко утворює сіро-білий оксид та покриття під впливом повітря. 9. Чистий метал кальцію реагує досить енергійно з водою, що виділяє газоподібний водень. 10. У порошкоподібній формі реакція з водою є надзвичайно швидкою та досить сильною, оскільки збільшена площа поверхні порошку прискорює реакцію. 11. У першому столітті римляни готували вапно як окис кальцію, але не визнавали його металом.
Цікаві факти про кальцій12. Кальцій не був виділений в якості металу до 1808 року, коли англієць сер Хамфрі Деві електролізував суміш вапна та оксиду ртуті. Шведські хіміки Берцеліус і Понтін створили амальгаму кальцію шляхом електролізу вапна у ртуті. Використовуючи ідею амальгами, Деві вдалося виділити чистий металевий кальцій. 13. Кальцій має точку плавлення 1548°F (842°C) та точку кипіння 2703°F (1484°C). 14. Кальцій міститься в організмі людини у вигляді іонів кальцію, він відсутній у його елементній формі. Це 5 найпоширеніший елемент у наших тілах. 15. Приблизно одна третина маси людського тіла – це кальцій після видалення всієї води. Кальцій дуже важливий для організму людини. 16. 99% кальцію організму зберігається в кістках та зубах, що сприяє їх зміцненню. Інші 1% допомагають з рухом м’язів, дозволяючи нервам переносити повідомлення між мозком та нашими частинами тіла. Це допомагає кровоносним судинам рухати кров навколо та допомагає з випуском гормонів та ферментів. 17. Ми переважно отримуємо кальцій у нашому організмі через їжу. Вітамін D необхідний для поглинання цього кальцію. Як мінерал кальцій міститься в багатьох харчових продуктах, особливо в таких молочних продуктах, як молоко, йогурт та сир. Овочі, такі як брокколі, капуста та шпинат, також містять кальцій. 18. З’єднання кальцію використовуються при виготовленні цементу, скла, вапна, цегли, фарби, паперу, цукру, видалення неметалічних домішок з сплавів і як відновник при отриманні інших металів. 19. Солі кальцію використовуються для одержання темно-жовтогарячого кольору при феєрверках.
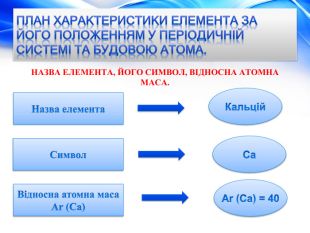
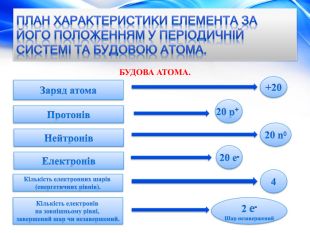
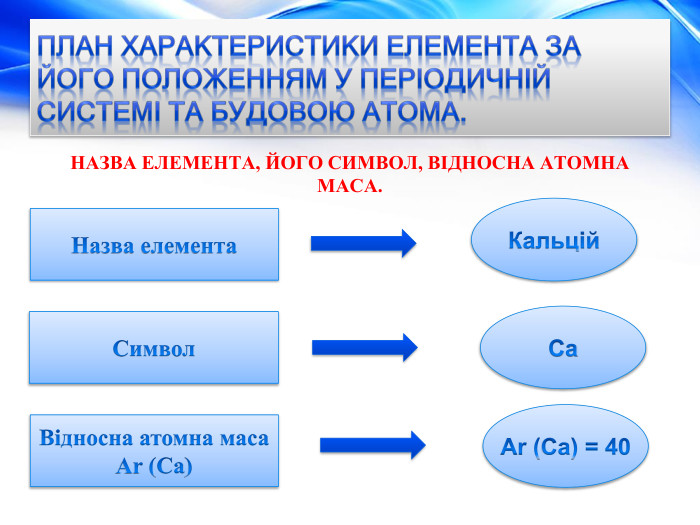
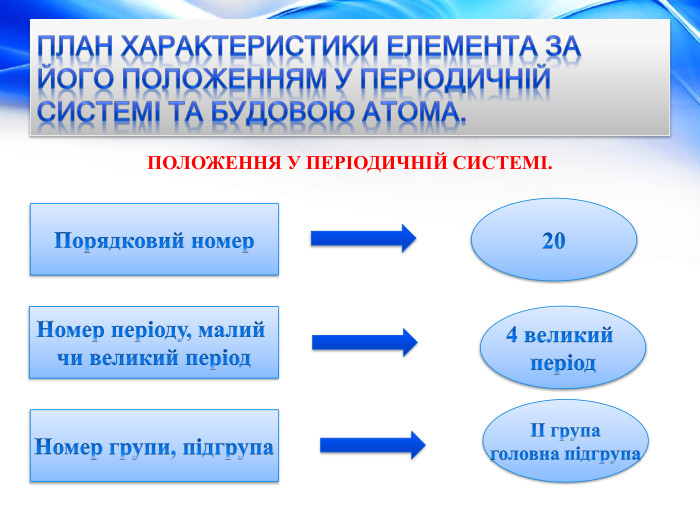
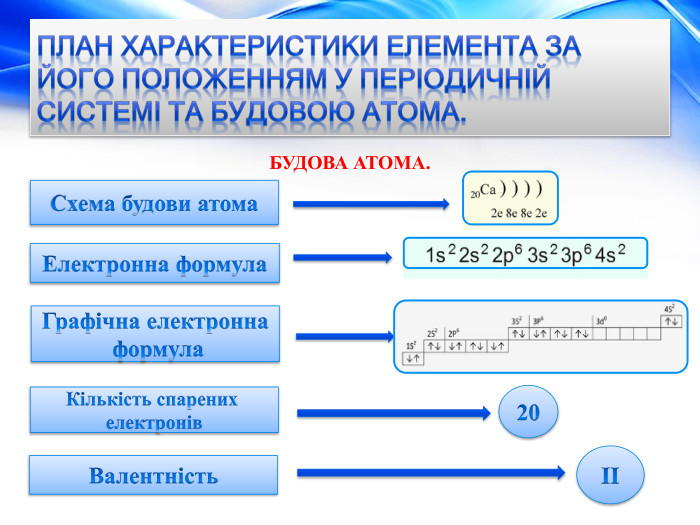
План характеристики елемента за його положенням у періодичній системі та будовою атома. БУДОВА АТОМА.+20 Заряд атома. Протонів. Нейтронів. Електронів. Кількість електронних шарів (енергетичних рівнів). Кількість електронів на зовнішньому рівні, завершений шар чи незавершений.20 p+ 20 n020 e-42 e-Шар незавершений
План характеристики елемента за його положенням у періодичній системі та будовою атома. ХАРАКТЕР ХІМІЧНОГО ЕЛЕМЕНТА. НАЗВА ТА ФОРМУЛА ПРОСТОЇ РЕЧОВИНИ. ХАРАКТЕР СПОЛУК ХІМІЧНОГО ЕЛЕМЕНТАs – елемент; металічний елемент Кальцій Ca – лужноземельний метал Ca. O кальцій оксид виявляє основні властивостіВищий оксид Ca(OH)2 кальцій гідроксид, луг. Гідрат оксиду Не утворюється. Летка сполука з Гідрогеном
План характеристики елемента за його положенням у періодичній системі та будовою атома. Порівняння металічних властивостей із властивостями елементів, що стоять поряд у періоді та групі. Ca проявляє металічні властивості слабше за К, але сильніше за Sc, оскільки заряд ядра Ca (+20) більший, ніж у К (+19) і менший, ніж у Sc (+21). Тому Ca притягує валентні електрони сильніше, ніж К і слабше, ніж Sc.
План характеристики елемента за його положенням у періодичній системі та будовою атома. Порівняння металічних властивостей із властивостями елементів, що стоять поряд у періоді та групі. Ca проявляє металічні властивості слабше за Mg, але сильніше за Sr, оскільки радіус атома Ca (4 енергетичні рівні) більший, ніж у Mg (2 енергетичні рівні) і менший, ніж у Sr (5 енергетичних рівнів). Тому Ca притягує валентні електрони слабше за Mg, але сильніше за Sr.
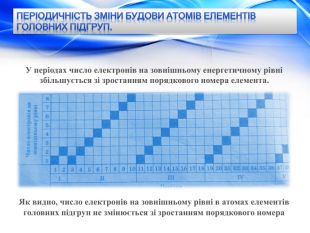
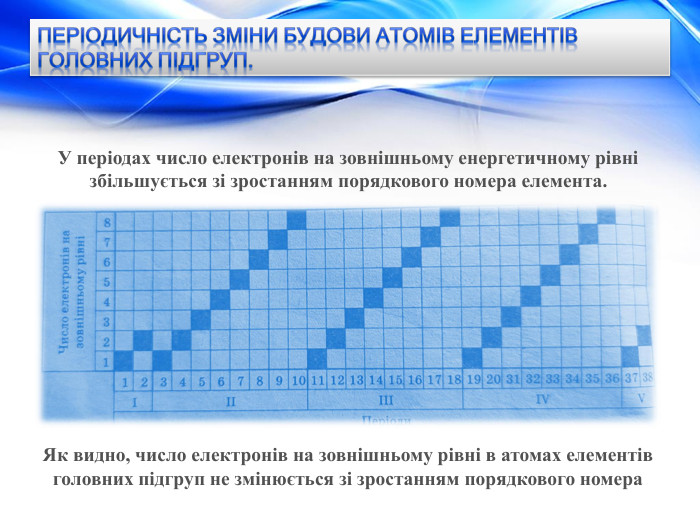
Періодичність зміни будови атомів елементів головних підгруп. У періодах число електронів на зовнішньому енергетичному рівні збільшується зі зростанням порядкового номера елемента. Як видно, число електронів на зовнішньому рівні в атомах елементів головних підгруп не змінюється зі зростанням порядкового номера


про публікацію авторської розробки
Додати розробку