Презентація "Хімічні формули речовин. Прості та складні речовини. "
Про матеріал
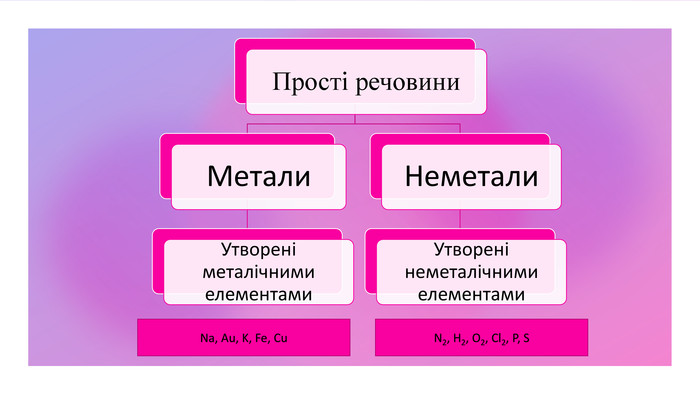
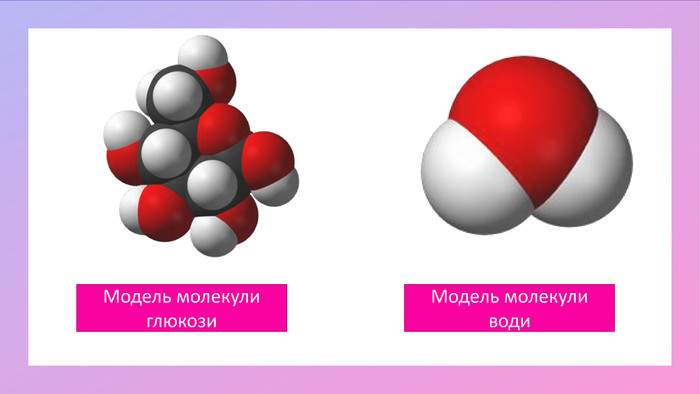
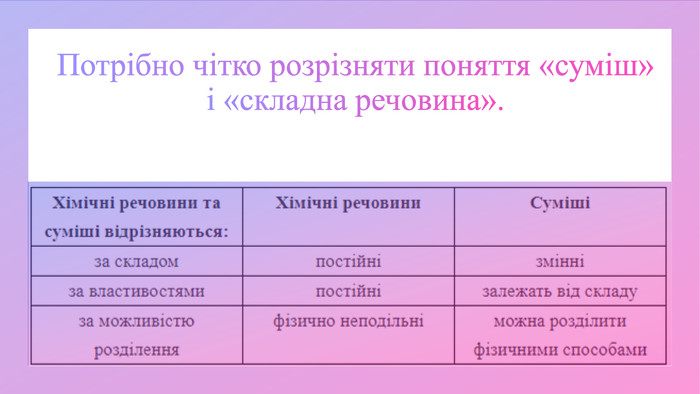
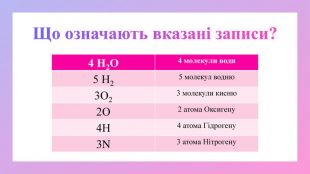
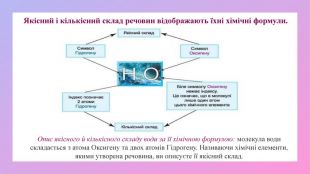
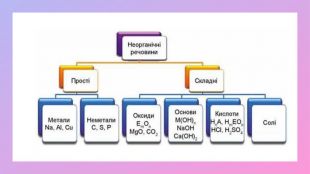
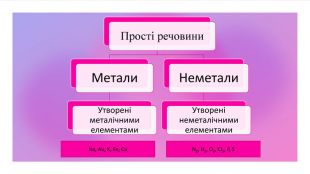
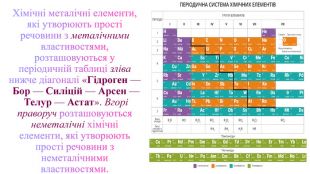
Поглибити знання учнів про класифікацію речовин за складом їх молекул; дати поняття про прості та складні речовини; вміння розрізняти поняття «проста речовина» і «хімічний елемент»; «складна речовина» «суміші»; навчити учнів аналізувати якісний склад простих і складних речовин; виховувати вміння не лише оволодівати інформацією, а й осмислювати і застосовувати її. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку









































-

Задорожна Лідія Яківна
04.11.2023 в 16:56
Дякую!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Новик Олена
01.11.2022 в 19:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Навроцька Валентина Василівна
20.10.2022 в 07:32
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Обертінська Вікторія
18.10.2022 в 18:43
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Фельді Віталій Йожефович
16.10.2022 в 20:09
Чудова, суперова робота, ДЯКУЮ!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

фертак наталя
01.11.2021 в 11:26
Дякую
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
4.0
-

Комлєва Олена Олексіївна
28.10.2021 в 02:32
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 4 відгука