Презентація «Хімічні властивості кисню» 7 клас
Про матеріал
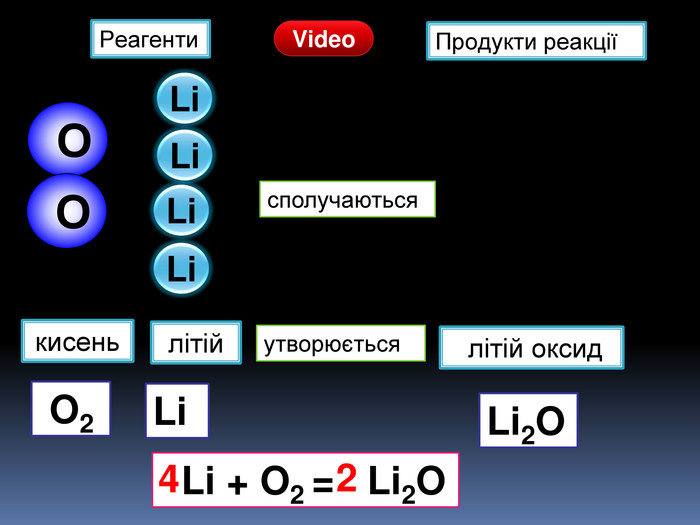
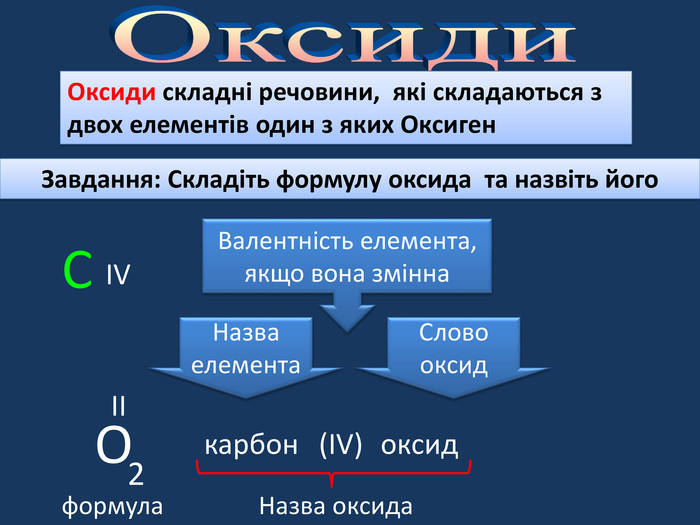
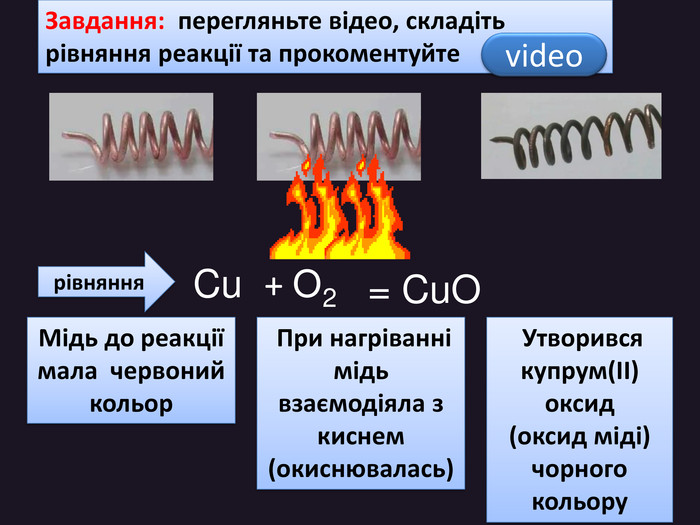
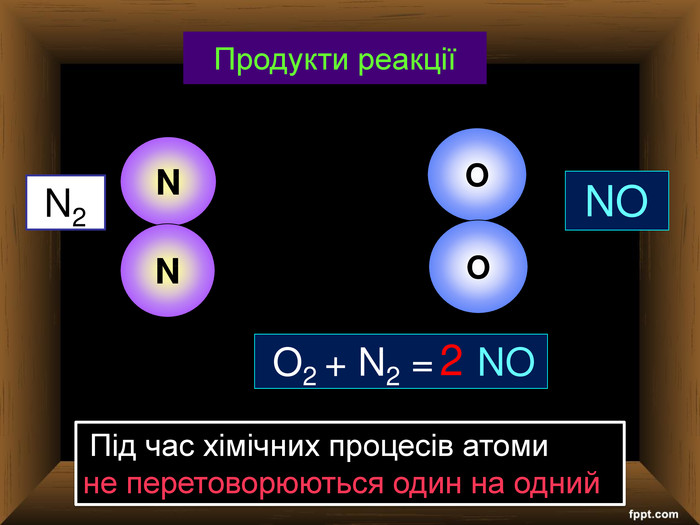
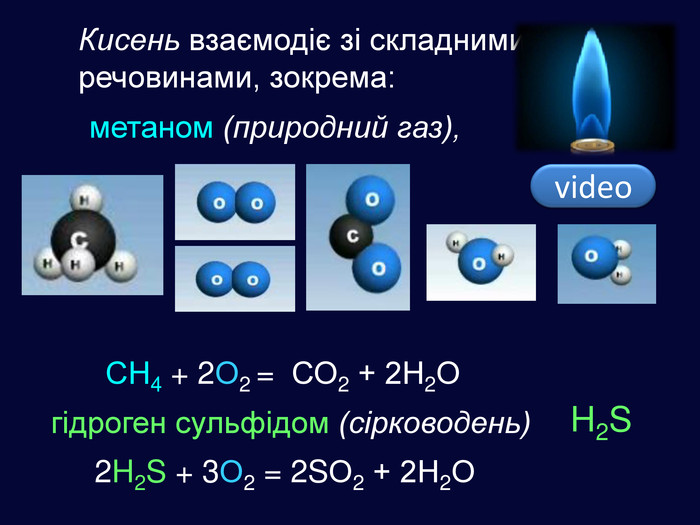
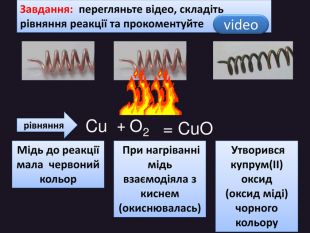
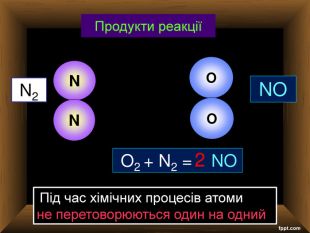
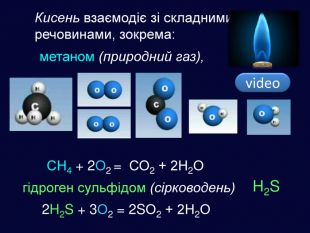
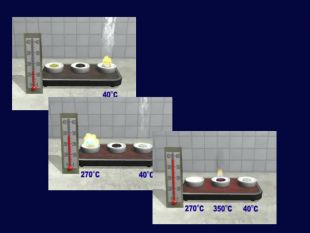
| Хімічні властивості кисню: взаємодія з простими речовинами (вуглець, водень, сірка, магній, залізо, мідь). Реакція сполучення. Взаємодія кисню зі складними речовинами (повне окиснення метану, гідроген сульфіду). |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку
































-

Шубіна Вікторія Вікторівна
01.04.2024 в 20:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Теребіленко Людмила Володимирівна
01.04.2023 в 22:40
Дякую. Ви супер!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Клочкова Ольга Анатоліївна
20.02.2023 в 00:04
Дякую за розробку презентації!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Арсенюк Наталія
14.03.2022 в 10:24
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Герасимчук Олена Петрівна
12.02.2022 в 15:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Петрук Людмила Миколаївна
09.02.2022 в 16:25
Дякую)
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Токарчук Тетяна Василівна
01.02.2022 в 19:07
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Паращак Наталія Миколаївна
15.04.2020 в 14:46
дякую!)
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Московченко Анастасія Ігорівна
08.04.2020 в 09:50
Загальна:
4.7
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ткач Надія
31.03.2020 в 23:24
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 7 відгуків