Презентація "Хімічні властивості солей"
Про матеріал
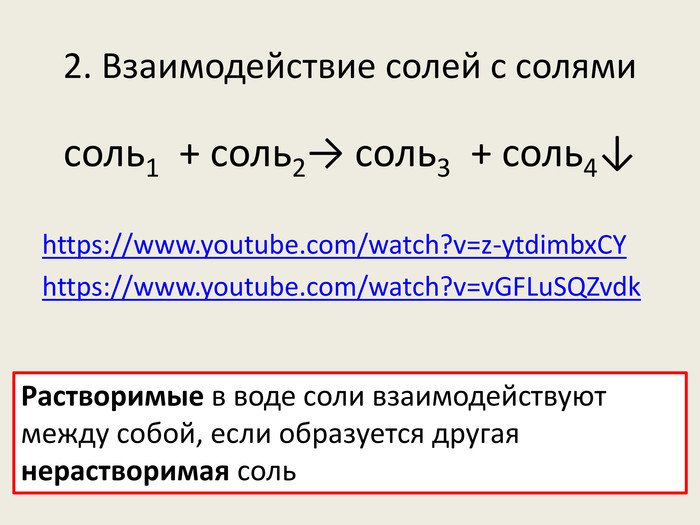
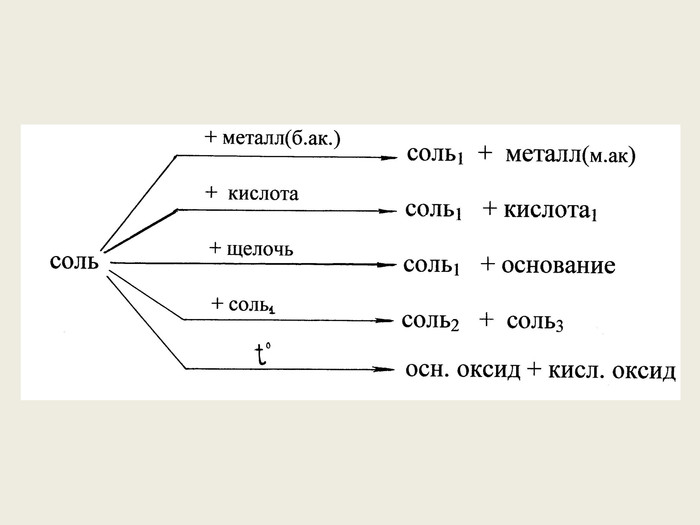
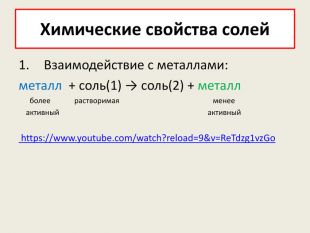
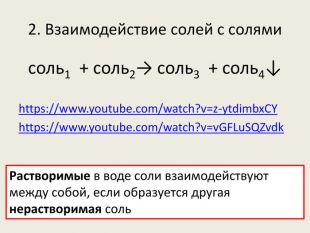
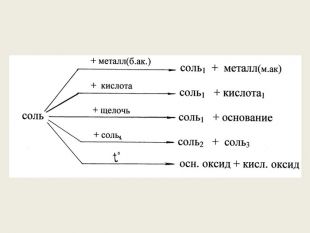
Презентація до уроку в 8-х класах з теми "Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями" Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку