Презентація "Хімічний зв'язок і будова речовин"
Про матеріал
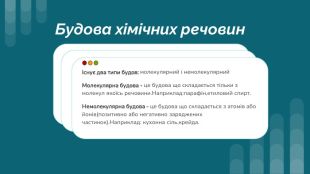
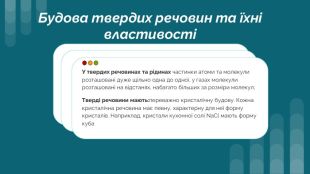
Хімічний зв'язок і будова речовин
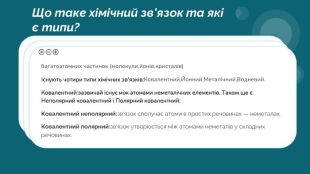
Хімічний зв'язок — це взаємодія атомів, що зумовлює існування двох- та багатоатомних частинок (молекул, йонів, кристалів). Розрізняють такі типи хімічного зв'язку: ковалентний, йонний, металічний та водневий Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку