Презентація "Хімія та проблеми екології"
























![Аналіз результатів Йони NO3- є дуже токсичними. В шлунково-кишковому тракті нітрати перетворюються в нітрити, які отруюють організм. Це виражається в порушенні реакцій поведінки, зниженні працездатності, запамороченнях, втраті свідомості. Ці солі пригнічують дихання клітин. В результаті в крові зростає вміст молочної кислоти, холестерину, лейкоцитів, зменшується кількість білків. З гемоглобіном нітрити утворюють метгемоглобін, який блокує центри перенесення кисню. Організм просто задихається. Людина відносно легко переносить дозу в 150 -200 мг нітратів в день (500 – гранично допустима норма для дорослих, для немовлят – 10 мг, 600 – токсична для дорослих). На нітрати існують гранично допустимі концентрації – ГДК [4]. Майже в межах ГДК показники зразків грунтів ТОВ «Колос»: 44.5 і 45.2 (норма 45 мл/дм). Аналіз результатів Йони NO3- є дуже токсичними. В шлунково-кишковому тракті нітрати перетворюються в нітрити, які отруюють організм. Це виражається в порушенні реакцій поведінки, зниженні працездатності, запамороченнях, втраті свідомості. Ці солі пригнічують дихання клітин. В результаті в крові зростає вміст молочної кислоти, холестерину, лейкоцитів, зменшується кількість білків. З гемоглобіном нітрити утворюють метгемоглобін, який блокує центри перенесення кисню. Організм просто задихається. Людина відносно легко переносить дозу в 150 -200 мг нітратів в день (500 – гранично допустима норма для дорослих, для немовлят – 10 мг, 600 – токсична для дорослих). На нітрати існують гранично допустимі концентрації – ГДК [4]. Майже в межах ГДК показники зразків грунтів ТОВ «Колос»: 44.5 і 45.2 (норма 45 мл/дм).](/uploads/files/964897/190592/205914_images/30.jpg)


Хімія та проблеми екології в Чернігівському районі Роботу виконала Короп Катерина Олександрівна, учениця 11 б класу Чернігівської спеціалізованої школи І-ІІІ ступенів «Надія» Чернігівської районної ради Запорізької області Науковий керівник: Стрижеус Лідія Василівна, вчитель хімії Чернігівської спеціалізованої школи І-ІІІ ступенів «Надія», спеціаліст вищої категорії, “вчитель-методист” Чернігівка - 2009
Мета роботи полягає в дослідженні хімічного складу гірських порід, мінералів, що залягають в надрах Чернігівського району, дослідженні якості питної води із скважин Чернігівського району, виявлення можливості використання їх в народному господарстві району, вивчення їх впливу на навколишнє середовище, визначення перспектив розвитку економіки району; дослідженні рН дощових вод періоду 2008 року, вплив кислотних дощів на ріст і розвиток сільськогосподарських рослин, на навколишнє середовище;
Новизна роботи: У даній роботі вперше дано аналіз рН дощових вод і визначено вплив кислотності води на ріст і розвиток рослин, дано аналіз хімічного складу і твердості води, визначено їх динаміку в різні пори року, проаналізовано хімічний склад основних гірських порід та мінералів Чернігівського району, їх вплив на навколишнє середовище та здоров’я населення та можливості для використання в народному господарстві району.
Практичне значення наукової роботи : матеріали роботи можуть використовуватись при вивченні шкільних курсів “Географія рідного краю” (теми “Грунти”, “Корисні копалини”, “Гірські породи і мінерали”, “Вода в природі”) та хімії (теми “Вода”, “Кислоти”, “Твердість води” та ін.) Результати досліджень використовувались на науково-практичній конференції для старшокласників після вивчення теми “Періодичний закон і періодична система хімічних елементів Д.І.Менделєєва” та при вивченні теми “Хімія та екологія” Тези роботи друкувалися в районній газеті “Нива”
Чернігівський район розташований на Приазовській височині – країні гранітів і сієнітів, скель і щебнястих степів, крейдяних і глиняних залежів, природних могил і джерел, звідки беруть свій початок Запорізькі малі річки (Молочна, Обіточна, Токмачка, Юшанли, Курушан, Каїнкулак). Пам’ятниками неживої природи є друга за висотою в Запорізькій області гора Токмак – Могила (Синя гора, 307 м) поблизу села Новополтавка – джерело давніх гранітів (сірих та червоних) і метаморфічних порід (в тому числі і залізистих кварцитів), ландшафтні заказники місцевого значення: “Урочище Скелі” (с. Верхній Токмак), та “Салтичійське степове помістя” (с.Салтичія).
ЧЕРНІГІВСЬКІ АПАТИТИ Родовище українських апатитів, відкрите в 1970 році, називається Новополтавським і знаходиться в Чернігівському районі за 2 км на схід від Новополтавки. Основна корисна сировина – апатитна руда, що складається з фосфоритів (3Са3(РО4)2СаF2СаСl2Са(ОН)2), Урану, Торію та інших рідкоземельних металів (лантаноїдів та актиноїдів) та супутніх порід: магматитів (Fe3О4), сидеритів (FeСО3), криолітів (Na3АlF6), базальту, що складається з Fe, Mg, Cu, Au, U. Отримуваний з руди концентрат відповідає першому сортові хібінських руд, найякісніших в світі, що знаходяться на Кольському півострові. За новою технологією в рік можна було б добувати до 1650 тис. тонн апатитового концентрату, що містить 38% фосфорного ангідриду Р2О5.
До складу апатитів входить велика кількість хімічних елементів: Кальцій, Фосфор, Оксиген, Гідроген, Флуор, Хлор, Ферум, Купрум, Карбон, Натрій, Алюміній, Магній, Аурум, Аргентум, Гідроген, рідкоземельні елементи: Скандій, Ітрій, Лантан і лантаноїди, Уран, Торій, актиноїди, Радій. Що стосується актиноїдів, то слід відмітити, що всі актиноїди радіоактивні – стабільних ізотопів у них немає. Тільки у двох: Торію і Урану є природні ізотопи з такими великими періодами піврозпаду, що вони співрозмірні з віком Землі. Тому Уран і Торій в помітних кількостях містяться в земній корі, від інших актиноїдів залишилися лише сліди. Вірогідно, вони існували на планеті під час її формування, але через високу швидкість радіоактивного розпаду всі їх ізотопи розпалися, перетворившись в надрах в інші елементи. Апатитні концентрати придатні для отримання фосфорних добрив. При експлуатації цього родовища можуть бути використані карбонатні крихти (для вапнування кислих грунтів), слюдисті квасці збагачення (їх можна використовувати під час виробництва кераміки, рубероїду), Також у процесі переробки апатитів може бути налагоджений видобуток вапнякових піщаників (придатні для обличкувальної плитки), опоки як легкого наповнювача для бетону. На сьогодні Новополтавське апатитне родовище включене до переліку родовищ Запорізької області, які перспективні для першочергової розробки.
Родовище підготовлене до виробітку з комплексним використанням руд. З початком роботи по добуванню апатитів в районі могли б бути вирішені важливі соціальні та економічні проблеми: наповнення бюджету, створення значної кількості робочих місць, підвищення заробітної платні, вирішення проблем освіти, медицини, будівництва житла, об’єктів соцкультпобуту, в цілому розвитку району. Але в зв’язку з тим, що супутніми елементами Чернігівських апатитів є Уран, Торій, лантаноїди і актиноїди, при розробці проекту експлуатації родовища обов’язковою є оцінка впливу на довкілля, при цьому розглядається не лише вплив на природне середовище, а й на соціальні та економічні умови району.
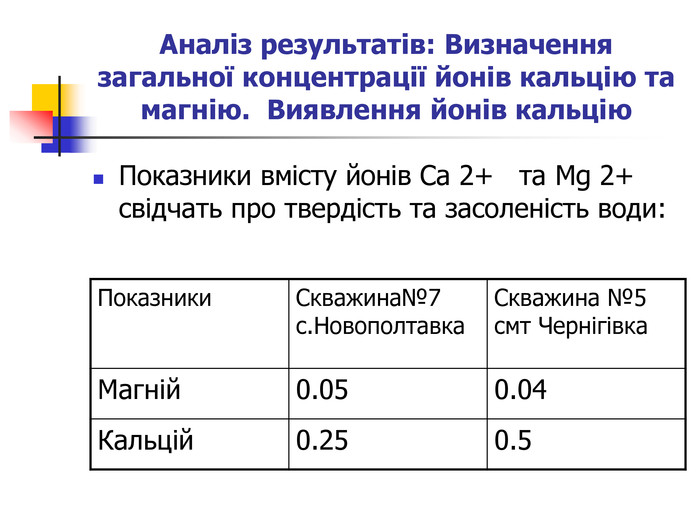
Динаміка хімічного складу, твердості підземних вод із скважин Чернігівського району При підготовці була проведена слідуюча робота: Визначення у воді іонів Cl-, SO42-, NO3-, CO32-, HCO3- Визначення сухого залишку у воді. Визначення твердості води. Виявлення кальцію. Визначення концентрації йонів кальцію та магнію.
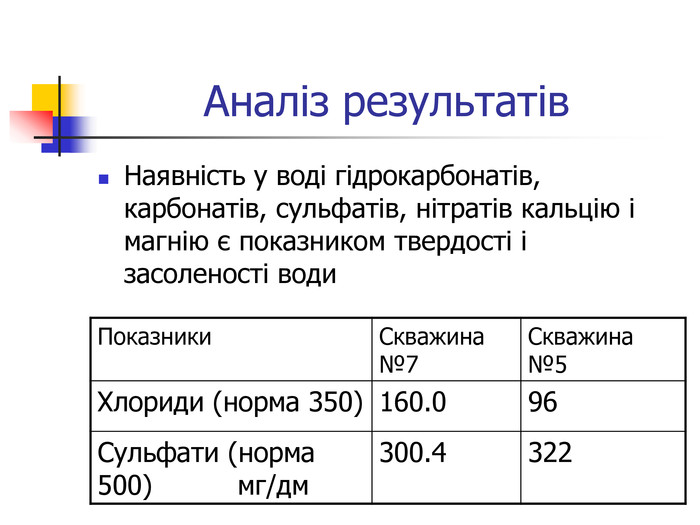
Визначення у воді іонів Cl-, SO42-, NO3-, CO32-, HCO3- Матеріали та обладнання: проба води, 0.1 н розчин AgNO3, 2н розчин BaCl2, пробірки, 2 н розчин HNO3. Методика: до 2-3 крапель досліджуваної води додавали 2-3 краплі 0.1 н розчину AgNO3. Утворюється білий осад або каламуть: Ag+ + Cl- = AgCl До 2-3 крапель аналізованої води додати 1 мл 2н розчину HNO3 та 2-3 краплі розчину Ba Cl2. Утворюється білий осад, що не розчиняється в азотній кислоті: Ba 2+ + SO4 2- = BaSO4. Досліди проводились з пробами води з різних джерел. Хімізм досліджень: MgCl2 + 2AgNO3 =2AgCl + Mg(NO3)2 (виявлення хлоридів) MgSO4 +BaCl2 = BaSO4 + MgCl2 (виявлення сульфатів) СaCO3 + 2HCl = CaCl2 + CO2 + H2O (виявлення карбонатів) Ca(HCO3)2 = CaCO3 + CO2 + H2O (виявлення гідрокарбонатів)
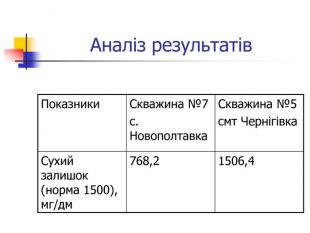
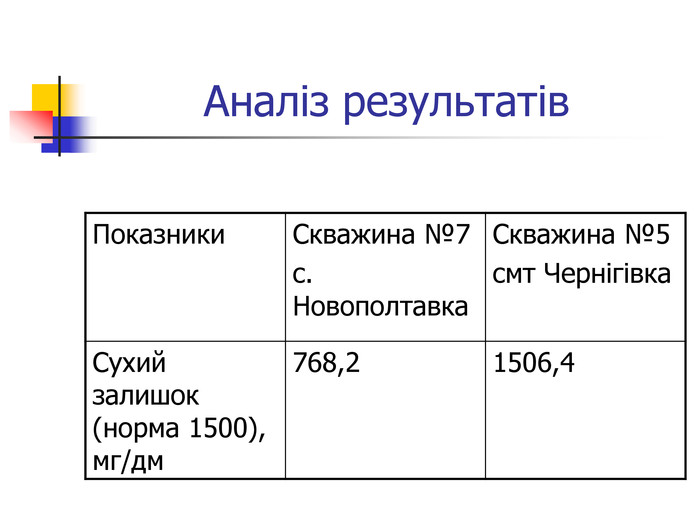
Визначення сухого залишку у воді Матеріали і обладнання: шафа сушильна, баня водяна, посуд мірний: піпетки 25 мл, колби мірні 250 мл та 500 мл, чашка випарювальна на 50-100 мл, терези. Методика: 250-500 мл профільтрованої води випарюють у чашці на водяній бані. Потім чашку з сухим залишком вміщюють до сушильної шафи і сушать до сталої маси. Обробка результатів: Х = ( m – m1) 100% /V, де Х – сухий залишок; m – маса чашки із сухим залишком, мг; m1 – маса чашки пустої, мг; V – об’єм води, взатої для аналізу. Норми : 1000 мг/л , не більше 1500 мг/л.
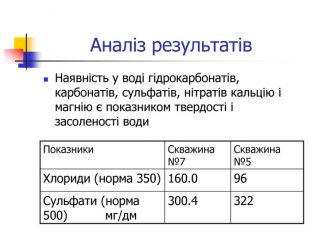
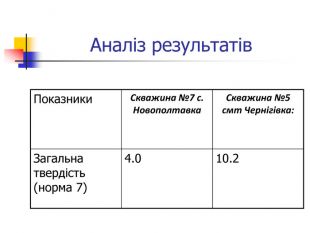
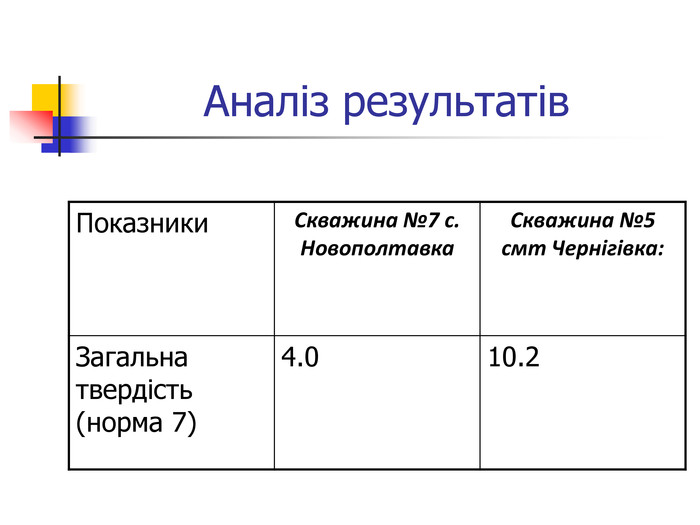
Вода, що біжить вапнистими гірськими породами, взаємодіє з оксидом карбону (1У) і перетворює карбонати кальцію і магнію на розчинні кислі солі – гідрокарбонати, а сама вода стає твердою. Твердість води обумовлена наявністю у воді гідрокарбонатів кальцію та магнію, сульфатів, хлоридів, нітратів кальцію і магнію. Тверда вода здебільшого непридатна до використання в промисловості та в побуті, хоча в санітарно-гігієнічному відношенні йони кальцію і магнію не шкідливі. Твердість прісної води залежить від джерела і пори року. Під час весняних паводків твердість води зменшується, а в зимовий період підвищується. Проби води із найбільших скважин Чернігівського району: №7 с.Новополтавка та №5 смт Чернігівка взято в зимовий, весняний і літній періоди. Новополтавська вода має твердість 4,0 моль/м3 і відноситься до вод середньої твердості, а Чернігівська вода при твердості 10 моль/м3 є твердою (за зимовими показниками).
Визначення твердості води Матеріали та обладнання: конічні колби, прилад для титрування, зразки води з різних скважин, індикатор хроматоген – чорний, трилон Б. Суть методу полягає в титруванні проби води розчином трилону Б у лужному середовищі (рН=10) з індикатором хромоген-чорним. Трилон Б утворює з йонами Кальцію та Магнію безбарвні комплексні сполуки. Комплекс Кальцію більш міцний, тому при титруванні утворюється в першу чергу. Індикатор хромоген-чорний утворює з йонами Магнію комплексну сполуку червоно-фіолетового кольору, яка при додаванні трилону Б руйнується внаслідок утворення більш міцного трилонатного комплексу. При цьому червоно-фіолетовий колір комплексу MgInd змінюється на блакитний внаслідок появи в розчині вільного індикатора Н2Ind. Цим методом визначають сумарний вміст солей Кальцію та Магнію, що дорівнює загальній твердості води.
Виявлення йонів кальцію Матеріали і обладнання: конічні колби, прилад для титрування, зразки води з різних скважин, дистильована вода, трилон Б, натрій гідроксид. Методика аналізу: до води (25 мл) додають 2 мл натрій гідроксиду до забарвлення розчину в рожевий колір. Одразу ж титрують трилоном Б (якщо затриматися з титруванням, то затримається зміна кольору індикатора). Титрування проводять повільно, ефективно перемішуючи до переходу рожевого забарвлення в фіолетове. Записують кількість витраченого трилону Б на титрування. Під час додавання надлишку трилону Б забарвлення не змінюється, тому титрування проводиться з дистильованою водою. Вміст визначають за формулою: C x = C (тр.) x V (тр.) x 100 / V ( H 2 O), де C (тр.) - концентрація трилону Б; V (тр.) - об’єм трилону; V ( H 2 O) – об’єм води.
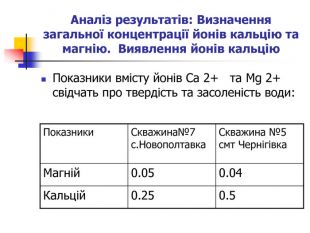
Визначення загальної концентрації йонів кальцію та магнію Матеріали і обладнання: конічні колби, прилад для титрування, зразки води з різних скважин, аміачно-буферний розчин, хроматоген – чорний, трилон Б. Методика аналізу: до води (25 мл) додають 5 мл аміачно-буферного розчину і хроматоген-чорний в такій кількості, щоб розчин забарвився у винно-червоний колір. Забарвлений розчин негайно титрують трилоном Б, енергійно помішувати до переходу забарвлення через бузковий до синьо-голубого. Записують нормальність трилону Б та його кількість витрачену для титрування: від суми відняти кількість трилону Б, витраченого на титрування Са 2+ , знаходять кількість трилону Б, витраченого на титрування Mg 2+, перемножують на поправку 4.8.
За своїми властивостями і хімічними показниками більш придатною для пиття є вода з Новополтавської скважини, проте проблема забезпечення жителів смт Чернігівки новополтавською водою залишається відкритою через необхідність значних капіталовкладень в реконструкцію системи водозабезпечення селища. Хоча східна і північно-східна частина селища все ж таки користується питєвою водою саме з цієї скважини. Через те, що жителями селища споживається здебільшого тверда вода, в районі високий рівень захворюваності нирок, печінки і жовчного міхура, пов’язаних з відкладанням в цих органах каменів. Тому вивчення підземних вод з метою їх найбільш ефективного використання в інтересах людини, а також вирішення проблем водозабезпечення населених пунктів району є досить актуальним питанням в районі. Особливого значення набуває також бережне використання питної води і вирішення проблеми її очистки.
КИСЛОТНІ ДОЩІ Вода необхідна для життя і є важливим лімітуючим фактором. У надземних екосистемах вона надходить з атмосфери у вигляді опадів: дощу, снігу, граду, роси. Окcиди Сульфуру й Нітрогену, що викидаються в атмосферу внаслідок роботи котелень і автомобільних двигунів, сполучаються з атмосферною вологою й утворюють дрібні крапельки сульфатної і нітратної кислот, які переносяться вітром у вигляді кислотного туману й випадають на землю кислотними дощами.
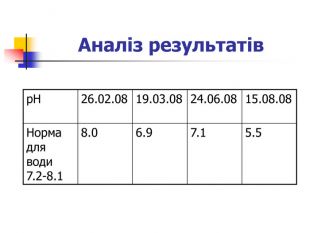
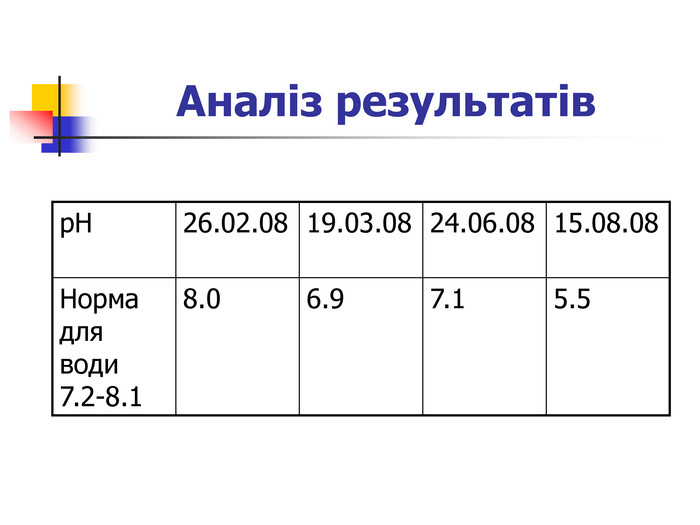
Практикум Визначення рН дощових вод Суть методу полягає у вимірюванні активності йонів Н+ потенціометричним методом. Матеріали і обладнання: рН-метр, проби води 10-20 мл, хімічний стакан 50 мл. Хід аналізу: готують до роботи рН-метр згідно з інструкцією. Настоюють рН-метр за допомогою буферних розчинів, в яких рН дорівнює 4.01; 6, 86; 9.18. У досліджувану воду опускають скляні електроди і за допомогою рН-метра визначають величину рН досліджуваного водного середовища. Досліди повторювали з пробами дощових вод зимового, весняного і літнього періодів 2008 року.Досліди повторювали з пробами дощових вод зимового, весняного і літнього періодів 2008 року. Найбільша кислотність дощової води виявлена у серпні 2008 року. Після такого дощу пожовкли і почали в’янути листки огірків, малини, кабаків.
Найбільша кислотність дощової води виявлена у серпні 2008 року. Після такого дощу пожовкли і почали в’янути листки огірків, малини, кабаків. Зміни рН водного середовища до значень нижче від 5.0 або вище ніж 8.0 загрозливі для живих організмів. Шкіра людини має слабо кислу реакцію (рН 4.5 – 5.5). Тому тривале перебування людини під дощем із значною різницею рН дощової води та рН тіла негативно впливатиме на стан шкіри. Отже, кислотні дощі вкрай шкідливо впливають на навколишнє середовище: знижується врожайність більшості сільськогосподарських культур внаслідок ушкодження листків кислотами; вимиваються з грунту Кальцій, Калій, Магній, що викликає деградацію флори і фауни; збільшується кількість захворювань людей (подразнення очей, хвороби дихальних шляхів); отруюється вода ставків, де гинуть риби, комахи.
ЗМІНА ХІМІЧНОГО СКЛАДУ ГРУНТІВ ЯК РЕЗУЛЬТАТ ХІМІЗАЦІЇ РОСЛИННИЦТВА Чернігівський район розташований в межах сухого спепу. Грунтовий покрив його представлений, в основному, чорноземами. Рідше зустрічаються каштанові грунти в комплексі з солончаками, а в долинах річок – пойменні грунти. Південні чорноземи містять достатню кількість поживних речовин. Основні грунтоутворюючі елементи – Калій, Натрій, Кальцій, Магній, Алюміній, Ферум, Карбон, Силіцій, Нітроген, Фосфор, Оксиген, Сульфур, Гідроген, Хлор. Одним з найпоширеніших елементів у грунті є Нітроген. Наявність у грунті зв’язаного азоту - основна умова родючості грунтів. Нітроген попадає в грунт у вигляді органічних сполук після відмиранння рослин і тварин.
Виявлення нітратів фотометричним методом Принцип методу: у кислому середовищі нітрат-іони утворюють з натрій саліцилатам суміш 3-нітросаліцилової та 5-нітросаліцилової кислот, солі яких у лужному середовищі мають жовтий колір. Методика аналізу: До фільтрату, одержаного із зависі грунту і води (5мл), додають 1 мл розчину натрій саліцилату і випарюють до сухого залишку у порцеляновій чашці на водяній бані. Після охолодження додають до сухого залишку 1 мл сульфатної кислоти, залишають на 10 хв. Вміст чашки розбавляють дистильованою водою, кількісно переносять у мірну колбу на 50 мл, додають 7 мл натрій гідроксиду, доводять до мітки дистильованою водою, перемішують і вимірюють оптичну густину в кюветі вузькою стороною. Розчин порівняння – дистильована вода. Дані порівнюють з графіком концентрації Нітрогену в йоні NO3- . Вираховують у мг/л за формулою: а х 1000/5=а х 200, де а – маса Нітрогену в йоні NO3- , що відповідає даному вмісту Нітрогену в йоні NO3- на 100 мл, знайденому за показами приладу; 5 – маса початкового розчину, взятого для випарювання (мг); 1000 – перерахунок на 1 л розчину. Для перерахунку на N від NO3- - до N використовують коефіцієнт 0.226.
Аналіз результатів Йони NO3- є дуже токсичними. В шлунково-кишковому тракті нітрати перетворюються в нітрити, які отруюють організм. Це виражається в порушенні реакцій поведінки, зниженні працездатності, запамороченнях, втраті свідомості. Ці солі пригнічують дихання клітин. В результаті в крові зростає вміст молочної кислоти, холестерину, лейкоцитів, зменшується кількість білків. З гемоглобіном нітрити утворюють метгемоглобін, який блокує центри перенесення кисню. Організм просто задихається. Людина відносно легко переносить дозу в 150 -200 мг нітратів в день (500 – гранично допустима норма для дорослих, для немовлят – 10 мг, 600 – токсична для дорослих). На нітрати існують гранично допустимі концентрації – ГДК [4]. Майже в межах ГДК показники зразків грунтів ТОВ «Колос»: 44.5 і 45.2 (норма 45 мл/дм).
Висновки У сучасних умовах, коли масштаби екологічних змін досягли критичного рівня, формування екологічної освіти підростаючого покоління стало соціальним замовленням держави, яке сформульоване в багатьох нормативних документах, концепції розвитку освіти у ХХІ столітті, концепції екологічної освіти. Тому, на мій погляд, у процесі наукового забезпечення збалансованого екологічного і соціального розвитку суспільства та збереження довкілля чільне місце повинне займати формування в школярів системи знань та навичок раціонального природокористування, екологічних цінностей, активної позиції в природоохоронній діяльності.
Джерела інформації: Бадіон О.П. Урочище скелі //Vita-Жизнь. – 2000. - №8. Березицький В.І.Чернігівські апатити //Запорізька правда. - 2001. - № 68. Білявський Г.О. Основи екологічних знань.- К.: Либідь, 1997.- 286 с. Губський Ю.І.та ін.Хімічні катастрофи і екологія. К.:Либідь, 1993.- 223 с. Войлошніков В.Д. Методика вивчення географії Запорізької області. Частина 3. Фізична географія. Запоріжжя-Мелітополь. – 1980. - 122 с. Дерпгольц В.Ф. Мир воды.-Л.: Недра, 1979.- 254 с. Добровольский В.В. Химия Земли.- М.: Просвещение, 1988.-176 с. Євенко П.П. Географія рідного краю. Запорізька область. - Запоріжжя. Поліграф. – 2002. - 128 с. Краснікова Л.М., Рева М.Л. Основи екології та охорона природи.- К.: Шкільний світ, 2001.-64 с Михайлов В.І. Знову про апатити // Нива. - 1990. - № 51. Петрикін В.І. та інші. Історія міст і сіл Української УРСР. Запорізька область. Інститут історії академії наук УРСР. - К. – 1981. – 726 с. з іл. Прокоф’єв М.А. Неорганічна хімія. Енциклопедія школяра.- М.: Советская энциклопедия, 1975.-384 з іл.


про публікацію авторської розробки
Додати розробку