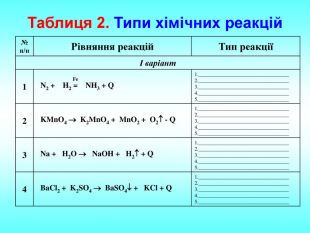
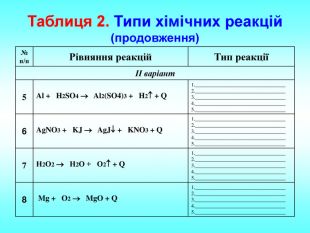
Презентація Класифікація хімічних реакцій
Про матеріал
Яскравий експеримент та наочність допомагають засвоєнню нового матеріалу та застосуванню його у повсякденному житті. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку