Презентація "Корозія металів"
Про матеріал
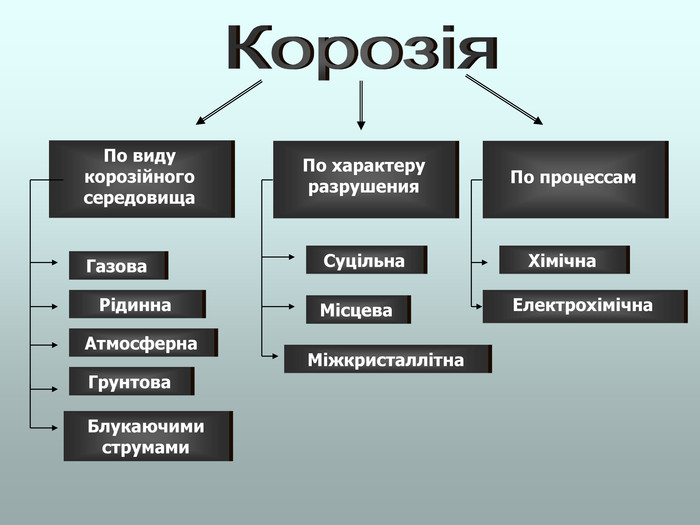
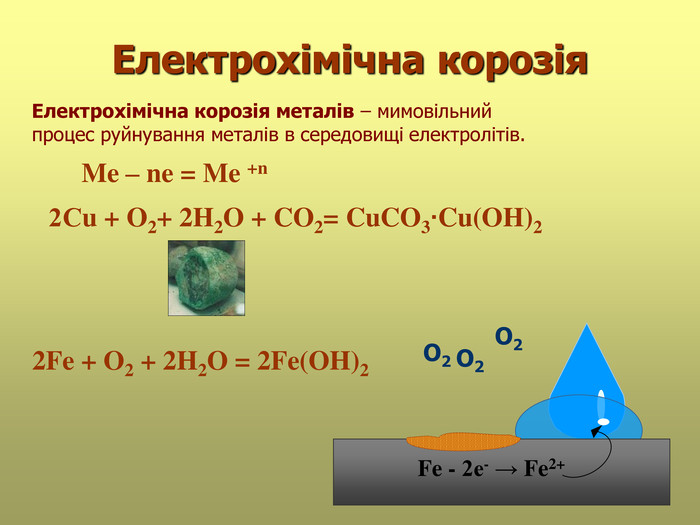
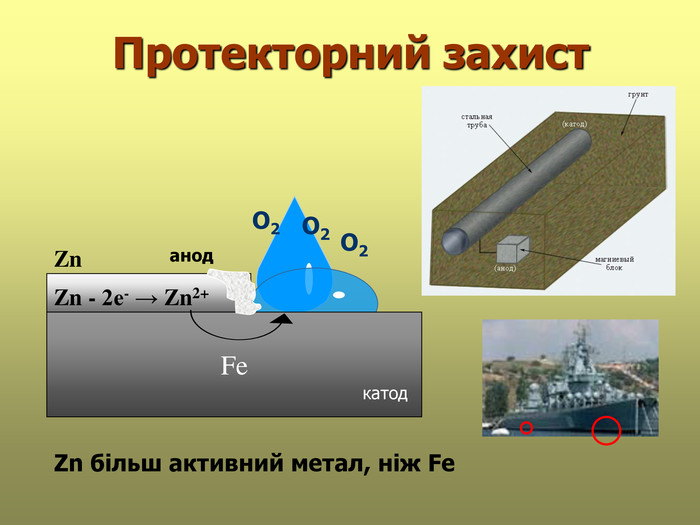
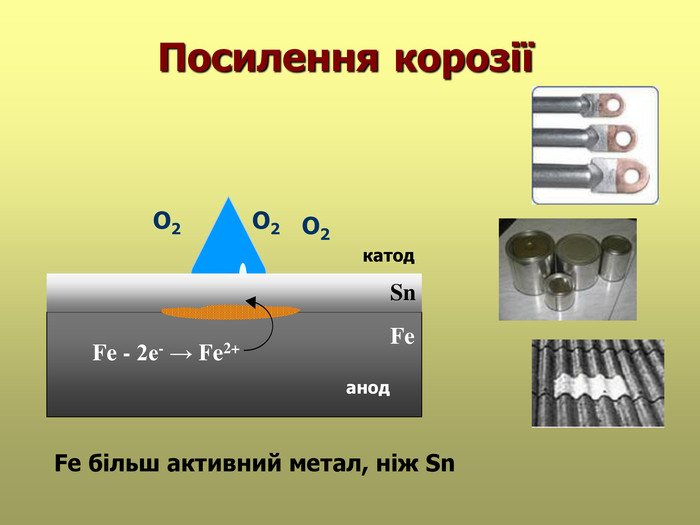
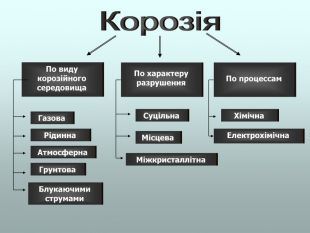
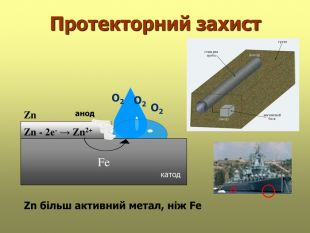
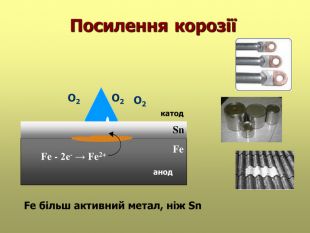
В презентації розглянуті поняття про корозію та її класифікацію, суть корозії та фактори, які спричиняють корозію, впливають на її швидкість; способи захисту від корозії; запропоновані завдання для закріплення вивченого матеріалу. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку