Лекція з теми "Елементи І А та ІІ А груп"
ВНЗ ЛОР «САМБІРСЬКИЙ ФАХОВИЙ МЕДИЧНИЙ КОЛЕДЖ»
ЦИКЛОВА КОМІСІЯ ХІМІЧНИХ ДИСЦИПЛІН
ЕлементИ І-А та ІІ-А ГРУП

Методична розробка
лекційного заняття з дисципліни “Неорганічна хімія” для студентів 2 – го курсу спеціальності “Фармація, промислова фармація”
Підготувала:
викладач неорганічної хімії КОВНАЦЬКА О.М.
“Хімік дає життя медикаменту, а лікар підтримує його перші кроки”
Із 70 виявлених в організмі хімічних елементів біологічне значення мають близько 20 основних незамінних елементів, які відіграють важливу роль в життєдіяльності організмів.
s – Елементи - K, Na, Ca, Mg постійно містяться в організмі у макрокількостях і є життєво необхідними.
Вони виконують роль пластичного матеріалу в побудові кісткових тканин, підтримують певні значення осмотичного тиску, рН середовища біологічних рідин, йонну та кислотно – основну рівновагу, а також стан колоїдних систем.
Катіони цих металів містяться в багатьох лікарських препаратах.
“ЕлементИ І - А та ІІ - А ГРУП”
І. Навчальна мета:
Мати поняття про поширення елементів І-А та ІІ-А груп у природі;
Знати:
- загальну характеристику металів, їх властивості;
- загальну характеристику елементів головних підгруп І та ІІ груп;
- електронну будову атомів s – елементів, їх ступені окиснення в сполуках;
- оксигеновмісні сполуки лужних та лужноземельних металів: їх властивості, способи добування;
- причини виникнення та методи усунення твердості води;
- біологічну роль та медичне застосування сполук елементів І-А та ІІ-А груп;
- якісні реакції Натрій- та Калій-іонів; йонів Магнію, Кальцію, Cтронцію, Барію.
Вміти:
- - охарактеризувати елемент за його положенням у періодичній системі
Д. І. Менделєєва та будовою атома;
- здійснювати хімічні перетворення;
- розв’язувати задачі, щодо даної теми.
ІІ. Виховна мета: виховання професійної спрямованості студентів, тактики фармацевта, правове виховання.
ІІІ. Міждисциплінарна інтеграція.
Дисципліна |
Знати |
Вміти |
І. Попередні дисципліни |
||
Хімія |
Будову, номенклатуру, класифікацію, добування, властивості металів І А та ІІ А груп та їх сполук.
|
Записувати рівняння відповідних реакцій; проводити експериментальні досліди, що характеризують властивості металів І А та ІІ А груп та їх сполук.
|
|
Техніка лабораторних робіт |
Правила техніки безпеки при роботі з лугами.
|
Проводити експериментальні досліди з дотриманням правил безпечної роботи.
|
|
Анатомія з основами фізіології |
Склад плазми, склад кісток, склад емалі зубів. Буферні системи крові |
|
ІІ. Наступні дисципліни |
||
|
Аналітична хімія |
Якісні реакції на виявлення катіонів металів І А та ІІ А груп. |
Записувати рівняння відповідних реакцій. |
|
Фармацевтична хімія |
Фармакопейні та не фармакопейні реакції ідентифікації катіонів металів І А та ІІ А груп . |
Записувати рівння реакцій ідентифікації спиртів. |
Фармакологія |
Групи лікарських препаратів. Лікарські препарати – похідні металів І А та ІІ А груп. |
|
ОЕФ |
Групи лікарських препаратів. Основні принципи зберігання лікарських засобів. Наказ №44 МОЗ України. |
Забезпечувати належні умови зберігання ЛЗ і розміщувати ЛЗ в умовах аптеки. |
Технологія ліків |
Вода очищена та вода для ін’єкцій:одержання, контроль якості, терміни зберігання, застосування |
Прогводити контроль якості на недопустимі домішки і вміти вести відповідну документацію. |
ІІІ. Внутрішньодисциплінарна інтеграція |
||
|
Неорганічна хімія |
Властивості металів інших груп періодичної системи Д.І. Менделєєва та їх сполук. |
Записувати рівняння відповідних реакцій. |
IV. Обладнання та технічні засоби навчання:
- Періодична таблиця елементів Д.І. Менделєєва.
- Слайди.
- Таблиця «Генетичний зв’язок між основними класами неорганічних сполук».
- Демонстраційні відеодосліди.
- Роздатковий матеріал (конспекти лекції, методичні рекомендації до ПСРС).
- Реактиви, хімічне обладнання.
- Лікарські препарати.
- Вислови.
Вид заняття: лекційне заняття з використанням мультимедійної презентації.
Місце проведення: лекційний зал практичного корпусу №2 «Фармація».
Тривалість: 80 хв.
V. Організаційна структура.
|
№ п/п |
Основні етапи і навчально – цільові питання |
Рівень |
Методи навчання |
Засоби навчання |
Час |
|
І. |
Підготовчий етап
|
|
|
Слайди
Слайди
|
6 хв. 1 хв. 3 хв.
2 хв. |
|
ІІ. |
Основний етап Тема: “Елементи І А та ІІ А груп””План
|
|
|
|
65 хв |
|
|
2. Загальна характеристика лужних металів.
|
α- ІІІ
|
Бесіда з використанням елементів проблемності
|
Слайди, таблиці ПС
|
|
|
|
3. Загальна характеристика елементів ІІ А групи та утворених ними простих речовин.
|
α- ІІІ
|
Запитання проблемного характеру, бесіда
|
Слайди, таблиці ПС
|
|
|
|
4. Сполуки лужних металів: добування та властивості.
|
α- ІІІ
|
Дискусія
|
Таблиця «Генетичний зв’язок між основними класами неорганічних сполук», слайди, відеодосліди, демонстраційні досліди (реактиви, хім.обладнання)
|
|
|
|
5. Сполуки лужноземельних металів: добування та властивості.
|
α- ІІІ
α- ІІ
|
Самостійна робота студентів (написання рівнянь реакцій)
Елементи бесіди; зв’язок викладач – студент
|
Дошка, слайди, демонстраційні досліди (реактиви, хім.обладнання) |
|
|
|
6. Твердість води та способи її усунення.
|
α- ІІІ
|
Бесіда, запитання проблемного характеру |
Слайди |
|
|
|
7. Біологічна роль елементів І А та ІІ А груп. Використання їхніх сполук у медицині та фармації.
|
α- ІІ
α- ІІ
|
Бесіда; Зв’язок з життям, практикою, новини в медицині
Інформаційні повідомлення, розповідь, поєднання навчання з вихованням |
Слайди, лікарські препарати, Фармакопея України, фрагменти відеофільмів
Слайди
|
|
|
ІІІ |
Заключний етап
|
|
|
Література для підготовки Основна: Левітін Є.Я. Загальна та неорганічна хімія В:Нова кн.,2003 р., ст.294-309 Додаткова: Романова Н. В. Загальна та неорганічна хімія К.: Ірпінь : ВТФ “Перун”, 2002 р., ст.312-342. 2. Методичні рекомендації до позааудиторної самостійної роботи № 14т.
|
9 хв.
6 хв
1 хв
2 хв |
VI. РЕКОМЕНДОВАНА ЛІТЕРАТУРА:
Основна: Левітін Є.Я. Загальна та неорганічна хімія В:Нова кн.,2003 р., ст. 279-309
Додаткова: Романова Н. В. Загальна та неорганічна хімія
К.: Ірпінь : ВТФ “Перун”, 2002 р., ст.312-342.
МАТЕРІАЛИ ОСНОВНОГО ЕТАПУ
ЗАГАЛЬНА ХАРАКТЕРИСТИКА ЛУЖНИХ МЕТАЛІВ
До головної підгрупи І-групи елементів періодичної системи належать лужні метали: Літій Li, Натрій Na, Калій K , Рубідій Rb, Цезій Cs, Францій Fr.
|
|
|
|
|
Літій
|
Натрій
|
Калій
|
|
Назва елемента |
Хімічний символ |
Будова зовнішнього електронного шару |
Назва простої речовини, формула |
Характерні ступені окислення |
|
Літій |
Li |
2s1 |
Літій, Li |
+1 |
|
Натрій |
Na |
3s1 |
Натрій, Na |
+1 |
|
Калій |
K |
4s1 |
Калій, K |
+1 |
У зовнішньому електронному шарі атомів лужних металів розміщується по одному електрону, тому атоми цих металів легко віддають 1 електрон, тобто мають низьку енергію іонізації, яка зменшується в підгрупі зверху вниз. Лужні метали легко утворюють катіони Ме+.
У ряду Li-Cs властивості простих речовин змінюються зі збільшенням протонного числа елемента – посилюються металічні властивості. Найактивніший з лужних металів є Францій. Всі лужні метали дуже сильні відновники; безпосередньо сполучаються майже з усіма неметалами.
Лужні метали дуже мякі, легкі, легкоплавкі, мають високі електро- і теплопровідність. На відміну від інших твердих металів характер плавлення натрію змінюється при накладанні додаткового тиску
Для Літію, Натрію, Калію, Рубідію характерний сріблясто-білий блиск.
Робота з лужними металами потребує обережності, оскільки вони легко займаються, бурхливо реагують з водою та іншими речовинами.
Поширення у природі
Лужні метали Na і K належать до поширених елементів (вміст у земній корі-2,5%), решта лужних металів менш поширені Li Rb Cs вважаються рідкісними елементами.
Лужні метали у вільному стані не трапляються.
Основні мінерали Натрію: Na2O Al2O3 6SiO2- натрієвий польовий шпат,NaCl-галіт (кам'яна сіль), Na2SO4 10H2O- мірабіліт тощо .
Основні мінерали Калію: K2O Al2O3 6SiO2-калієвий польовий шпат, KCl-сильвін, KCl NaCl- сильвініт, KCl MgCl2 6H2O- карналіт
Основні мінерали Літію: LiAl(SiO3)2 - сподумен, (Li,K)F2 Al(SiO3)2 літієва слюда тощо
ЗАГАЛЬНА ХАРАКТЕРИСТИКА ЕЛЕМЕНТІВ ІІ А ГРУПИ ТА УТВОРЕНИХ НИМИ ПРОСТИХ РЕЧОВИН
До головної підгрупи ІІ –групи елементів періодичної системи належать Берилій Be , Магній Mg, Кальцій Ca Стронцій Sr, Барій Ba, Радій Ra
|
|
|
|
|
Магній |
Кальцій |
Барій |
Всі елементи головної підгрупи ІІ –групи крім Берилію мають яскраво виявлені металічні властивості .
Магній дещо відрізняється за властивостями від Кальцію. Стронцію, Барію, Радію ,які виділяють в окрему групу- лужноземельні метали.
Будову зовнішніх електронних шарів атомів Mg, Ca, Sr. Ba можна подати формулою ns2+ . Ці метали легко віддають свої зовнішні валентні електрони і перетворюються на катіони Ме+ . Характерний ступінь окиснення +2
Активність цих металів зростає із збільшенням протонного числа. Всі метали головної підгрупи ІІ групи мають сріблястий блиск, досить м'які .
Поширення у природі.
Вміст цих елементів у земній корі становить Mg- 2,4%, Ca-2,96%,
Sr -4 10-2% ; Ba -5 10-2% Найпоширенішими є Кальцій і Магній.
У вільному стані метали головної підгрупи ІІ групи не трапляються .
Основні мінерали Mg MgSO4 7H2O-гірка сіль, KCl MgSO4 3H2O -каїніт, KCl ∙MgCl2 6H2Oкарналіт і ін.
Основні мінерали Са:СаСО3- вапняк, мармур, крейда CaSO4 2H2O- гіпс і ін.
СПОЛУКИ ЛУЖНИХ МЕТАЛІВ : ДОБУВАННЯ ТА ВЛАСТИВОСТІ
Оксиди:
Добування:
Тільки Літій при взаємодії з киснем утворює оксид Li2O, всі інші лужні метали – пероксиди або супероксиди :
4Li + O2 → 2Li2O (літій оксид)
2Na + O2 → Na2O2 (натрій пероксид)
K + O2 → KO2 (калій супероксид)
Робота з лужними металами потребує обережності, оскільки вони легко займаються, бурхливо реагують з водою та іншими речовинами. (
Оксиди Натрію ,Калію, Рубідію і Цезію можна добути окисненням у разі нестачі кисню :
4Na + O2 → 2Na2O
4K + O2 → 2K2O
aбо під час взаємодії стехіометричних кількостей металу і пероксиду
Na2O2 + 2Na → 2Na2O
Властивості:
Оксиди Li2O і Na2O -безбарвні, K2O і Rb2O -мають жовте забарвлення , Cs2O- оранжеве.
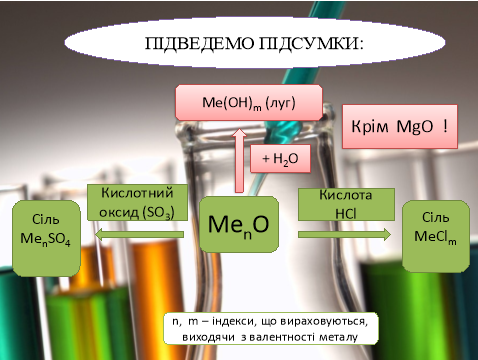
Оксиди лужних металів проявляють властивості характерні основним оксидам:
- взаємодія з водою:
Na2O + H2O =2NaOH K2O + H2O = 2KOH
- взаємодія з кислотами:
Na2O +2HCl =2NaCl + H2O Li2O +H2SO4 =Li2SO4 + H2O
- взаємодія з кислотними оксидами:
Na2O + SO3 = Na2SO4 K2O + CO2 = K2CO3
взаємодія з амфотерними оксидами:
Na2O + ZnO = Na2ZnO2
взаємодія з амфотерними гідроксидами (сплавляння):
Na2O + 2Al(OH)3=2NaAlO2 +3H2O
Гідроксиди
Гідроксиди Li, Na, K, Rb, Cs - безбарвні кристалічні речовини ,з порівняно невисокими температурами плавлення, добре розчинні у воді . Розчинні у воді гідроксиди LiOH KOH NaOH тощо називають лугами KOH і NaOH називають ще їдкими лугами (їдке калі, їдкий натр).
Добування
- В лабораторних умовах - взаємодія з водою :
- лужних металів (обережно!) :
2Na + 2H2O →2NaOH + H2
- оксидів лужних металів:
Li2O + H2O → 2LiOH
2) Луги у виробництві добувають електролізом водних розчинів їхніх солей (NaCl KCl):
2NaCl + 2H2O = H2 + Cl2 + 2NaOH,
а також дією на розчини їхніх карбонатів гашеним вапном :
Na2CO3 + Ca(OH)2 → CaCO3 ↓ + 2NaOH
Хімічні властивості
Гідроксиди лужних металів проявляють властивості характерні лугам:
- Взаємодія з кислотними оксидами:
2NaOH + CO2 → Na2CO3 + H2O
- Взаємодія з кислотами:
KOH + HCl → KCl + H2O
- Взаємодія з солями٭:
2LiOH + CuSO4 → Cu(OH)2 ↓+ Li2SO4
NaOH + NH4Cl → NaCl + NH3 ↑ + H2O
- взаємодія з амфотерними оксидами:
2NaOH+ZnO+Н2О=Na2[Zn(OH)4]
- взаємодія з амфотерними гідроксидами:
2NaOH+Zn(OH)2 = Na2[Zn(OH)4]
- взаємодія з металами, оксиди яких є амфотерними:
2NaOH+Zn+2H2O=Na2[Zn(OH)4] +Н2
Якісні реакції на Натрій-іони та Калій-іони :
К +:- солі Калію забарвлюють полум'я в бузковий колір
- дія Натрій гексанітрокобальтотатом (ІІІ)
Na3Co(NO2)6 + 2KCl → K2Na [Co(NO2)6]↓+ 2NaCl
жовтий осад
Na+ : Солі Натрію забарвлюють полум'я в жовтий колір .
- дія калій гексагідроксостибіату(v)
Na+ + K[Sb(OH)6] → Na[Sb(OH)6]↓ + K+
білий осад
СПОЛУКИ ЛУЖНОЗЕМЕЛЬНИХ МЕТАЛІВ: ДОБУВАННЯ ТА ВЛАСТИВОСТІ
Оксиди MgO, CaO, BaO
- Тверді;
- тугоплавкі сполуки;
- мають йонні кристалічні гратки.
Сильно прожарений MgO -дуже твердий ,втрачає здатність розчинятись у воді і кислотах. CaO – відомий під назвою негашене вапно.
Добування:
У промисловості і в лабораторії оксиди металів головної підгрупи ІІ групи добувають не з самих металів, а термічним розкладанням відповідних карбонатів . BaO зручно добувати нагріванням барій нітрату:
t
CaCO3 → CaO + CO2
MgCO3 t→ MgO + CO2
2Ba(NO3)2 → 2BaO + 4NO2 + O2
Хімічні властивості:
Хімічна активність цих оксидів зростає від MgO до BaO.
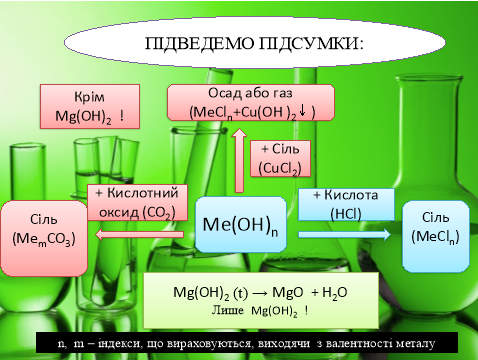
Оксиди лужноземельних металів проявляють характерні властивості основних оксидів:
CaO + H2O → Ca(OH)2
MgO + H2O ≠
MgO + 2HCl→ MgCl2 + H2O
SrO + 2HCl → SrCl2 + H2O
BaO + CO2 → BaCO3
СаO + 2Al(OH)3 = Сa(AlO2)2 +3H2O
Гідроксиди лужноземельних металів
Ca(OH)2 і Ва(ОН)2- тверді речовини білого кольору, розчинні у воді.
Ca(OH)2 - це гашене вапно, водний розчин якого називають вапняною водою.
Розчин Ва(ОН)2 (баритова вода) – важливий лабораторний реактив для якісного виявлення вуглекислого газу.
Гідроксиди кальцію, стронцію, барію - сильні основи, які за силою поступаються лише гідроксидам s-елементів І-групи.
В ряду Ca(OH)2 - Sr(OH)2 - Вa(OH)2 посилюється хімічна активність, розчинність, термічна стійкість.
Добування:
Гідроксиди лужноземельних металів (луги) можна добути взаємодією металів або їхніх оксидів з водою:
Ca + 2H2O → Ca(OH)2 + H2↑
BaO + H2O → Ba(OH)2
Гідроксид Магнію добувають дією лугу на розчинну сіль Магнію (загальний спосіб добування нерозчинних основ):
MgSO4 + 2NaOH = Na2SO4 + Mg(OH)2↓
Хімічні властивості:
Гідроксиди лужноземельних металів проявляють властивості характерні лугам:
- взаємодія з кислотними оксидами
Ca(OH)2 + CO2 → CaCO3 + H2O
- взаємодія з кислотами
Ba(OH)2 + HCl → BaCl2 + H2O
- взаємодія з солями
Sr(OH)2 + CuSO4 → Cu(OH)2 ↓ + SrSO4
- взаємодія з амфотерними оксидами:
Сa(OH)2+ZnO+Н2О=Сa[Zn(OH)4]
- взаємодія з амфотерними гідроксидами:
Сa(OH)2+Zn(OH)2 = Сa[Zn(OH)4]
- взаємодія з металами, оксиди яких є амфотерними:
Сa(OH)2+Zn+2H2O=Сa[Zn(OH)4] +Н2
Якісні реакції на іони Магнію,Кальцію, Стронцію, Барію:
Mg2+ :
- виявляють дією лугів:
MgSO4 + 2NaOH → Na2SO4 + Mg(OH)2↓
Mg2+ 2OH- → Mg(OH)2 ↓
Білий аморфний осад
- реакція катіонів Mg 2+ з натрій гідрогенфосфатом
(реакція фармакопейна, чутлива, використовується для визначення йонів Mg2+ у крові)
MgSO4 + Na2HPO4 + NH4OH →MgNH4PO4 ↓ + Na2SO4 + H2O
білий кристалічний
Са2+ :
- виявляють дією карбонатів:
Сa2+ +CO32- → CaCO3↓
білий осад
- солі Кальцію забарвлюють полум'я в цегляно-червоний колір
Ba2+ ,Sr2+: H2SO4 та її солі утворюють із цими катіонами білі кристалічні осади:
Вa2+ +SO42- → BaSO4↓
Sr2+ +SO42- → SrSO4↓
ТВЕРДІСТЬ ВОДИ
Вмістом у природній воді йонів Са2+ і Мg2+ зумовлена її твердість.
Застосування твердої води неможливе в ряді виробництв (у разі тривалого використання твердої води утворюється товстий шар накипу).
Сумарний вміст солей магнію і кальцію у воді називається її загальною твердістю.
Загальну твердість води поділяють на тимчасову, або карбонатну, і постійну, або некарбонатну.
Тимчасова твердість води зумовлена наявністю гідрогенкарбонатів кальцію і магнію, її можна усунути тривалим кип'ятінням води:
Ме(НСО3)2 = МеСО3↓ + Н2О + СО2↑.
Постійна твердість води зумовлена наявністю у воді солей сильних кислот — сульфатів і хлоридів магнію і кальцію; кип'ятінням постійну твердість води усунути неможливо.
|
Тимчасова твердість води (Са(НСО3)2; Мg(НСО3)2 ) |
|
Постійна твердість води (СаSO4; Мg SO4; СаCl2; MgCl2)
|
|
МЕТОДИ УСУНЕННЯ ТВЕРДОСТІ ВОДИ |
||
|
- тривале кип'ятіння води: Ме(НСО3)2 = МеСО3↓ + Н2О + СО2↑.
|
|
додавання соди(NaНСО3) або вапна Са(ОН)2 MgCl2+ Са(ОН)2 = 2СаCl2 + Mg(ОН)2↓
|
|
- додаванням вапна, яке переводить кислі солі у середні: Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О.
|
|
додавання Натрій ортофосфату Na3PО4 СаSO4 + Na3PО4 = Са3(PО4)2↓ + Na2SO4
|
Твердість води прийнято виражати числом міліеквівалентів (мекв) йонів Са2+ і Мg2+, що містяться в 1 л води (1 мекв = 20,04 мг/л Са2+ або 12,16 мг/л Мg2+)
Найм'якша вода у природі — це дощова та снігова.
БІОЛОГІЧНА РОЛЬ ЕЛЕМЕНТІВ І А ТА ІІ А ГРУП.
ВИКОРИСТАННЯ ЇХНІХ СПОЛУК У МЕДИЦИНІ ТА ФАРМАЦІЇ
В організмі людини йони Калію містяться в макрокількостях і тому є життєво необхідними.
Загальний вміст Калію становить 0,27% (мас.).
Солі Калію називаються електролітами. Вони входять у склад всіх рідин, які знаходяться в нашому організмі і беруть участь в широкому спектрі біохімічних реакцій. Йони Калію К+ є основними внутрішньоклітинними йонами.
Вони необхідні живим організмам для генерування біопотенціалів у нервовій системі, м'язах та секреторній тканині, а також для регулювання роботи серцевого м'яза (міокарда), йони Калію сприяють розслабленню м'язів.
В організмі людини обмін Калію може змінюватися при порушенні функцій нирок, серцево-судинної системи, шлунково-кишкових захворюваннях, цукровому діабеті, опіках, травмі, лікуванні кортикостероїдами, гемотрасфузіях.
Недостатність загальної кількості Калію в організмі призводить до змін в серцево-судинній системі, що супроводжується порушенням координації, сонливістю, брадикардією, гіпотензією, змінами на ЕКГ і порушенням ритму роботи серця, що є частою причиною раптової смерті.
Добова норма споживання калію для дорослої людини — не менше 2 -2,5г, а при фізкультурних заняттях це число зростає до 5 грам, так як під час різних фізичних навантажень серцево-судинна система починає працювати у два рази активніше. Калій ж якраз допомагає серцево-судинній системі працювати нормально.
Малий вміст калію в організмі викликає пониження тиску, аритмію, підвищує вміст холестерину в крові. робить кістки крихкими, погіршує роботу нирок, розвиває серцеві хвороби, безсоння і психологічні розлади. Продовжувати фізкультурні тренування стає небезпечно. Щоб прибрати вищевказані симптоми потрібно вивати продукти багаті на К.
Продукти , з високим вмістом калію — це продукти харчування рослинного походження:
- Сухофрукти і горіхи — рекордсмени за вмістом калію: курага, чорнослив, родзинки, мигдаль, фундук , арахіс, насіння соняшнику, кедрові горіхи, волоський горіх.
- Бобові і крупи містять калій у великій кількості: квасоля, горох, сочевиця, вівсяна крупа, гречана крупа, пшоно.
- Фрукти і ягоди також багаті калієм: банани, персик , абрикоси, виноград , яблука, хурма, апельсини, грейпфрут, мандарини, калина, журавлина, брусниця, чорниця.
- Овочі , які ми вирощуємо на своєму городі , теж можуть похвалитися високим вмістом калію: картопля, капуста брюссельська, томати, буряк, часник, моркву, топінамбур, цибуля, червоний перець.
- Продукти, що містять калій тваринного походження: м’ясо, риба, молочні продукти.
Використання сполук калію у медицині та фармації:
Калій оротат, Калій хлорид, аспаркам, панангін
- протиаритмічні засоби;
- при гіпокаліємії.
Калій йодид – очні краплі, відхаркувальний засіб;
Калій бромід – заспокійливий засіб.
Натрій як і Калій - життєво необхідний елемент.
В організмі людини на долю Натрію припадає 0,1% (мас.).
Солі Натрію входять у склад всіх рідин, які знаходяться в нашому організмі, в основному сконцентрований в крові та міжклітинній рідині.
Основна біологічна функція розчинних у воді сполук s-елементів полягає у підтриманні водно-електролітного балансу. Катіони цих елементів істотно впливають на стан наводнення клітин та в'язкість цитоплазми. Входячи до складу електролітів крові, йони Натрію забезпечують сталу величину осмотичного тиску, а як компоненти буферних систем - підтримують на певному рівні рН біологічних рідин.
Важливо знати, що йони Натрію Na+ є основними позаклітинними йонами.
Йони Натрію сприяють скороченню м'язів.
Добова потреба - 1г. Натрій міститься в таких продуктах харчування як: хлібопекарські вироби, молочні продукти, яйця.
Використання сполук натрію у медицині та фармації:
- Натрій хлорид 0,9% ізотонічний- як розчинник для інших лікарських засобів;
- Натрій бромід – у формі розчинів та мікстур, як заспокійливий засіб;
- Натрій гідрогенкарбонат – антацидний засіб, для інгаляцій при гострих респіраторних захворюваннях
Йони Са постійно містяться в організмі людини й тварин у макрокількостях. Вони необхідні для побудови тканин, оскільки мінеральні солі Кальцію у вигляді гідроксиапатиту Са50Н(Р04)3 є основою кісткової тканини, а фторапатит Са5F(Р04)3 — емалі зубів.
У плазмі крові йони Кальцію перебувають у зв'язаному з білками стані та у вільному йонізованому вигляді. Вони підтримують нормальну здатність крові до згортання, впливають на кислотно-основний стан біологічних рідин. Крім того, йони Кальцію регулюють поділ клітин, відіграють важливу роль у функціонуванні серцевого м'яза, гальмують збудження ЦНС. Значне збільшення концентрації йонів Са2+, особливо у серцевому м'язі, негативно впливає на метаболічні процеси і може викликати руйнування клітинних структур. У зв'язку з цим у медичну практику впроваджена група лікарських засобів, так званих антагоністів Кальцію, які блокують проникнення йонів Кальцію в міокард, поліпшуючи роботу серцевого м'яза.
Нестача Кальцію в організмі призводить до нервових розладів.
Надмірне нагромадження Кальцію в деяких органах призводить до утворення каменів.
За своєю біологічною дією Кальцій є фізіологічним антагоністом Магнію і Калію.
Крім того, йони Кальцію виявляють протизапальну та десенсибілізуючу дію, тому його сполуки використовують як лікарські засоби.
Добова потреба дорослої людини в сполуках Кальцію становить 1,0-1,3 г. Вона забезпечується за рахунок рослинної їжі, молока, питної води. Джерелами Кальцію є також зелені листкові культури, цвітна капуста, арахіс та насіння соняшника. В збираному молоці міститься Кальцію набагато більше, ніж в незбираному.
Засвоєння Кальцію організмом залежить від наявності в ньому вітаміну D, концентрація якого регулюється гормонами щитовидної залози.
“Ворогами” Кальцію є жири, щавлева кислота (яка міститься, наприклад, в шоколаді, щавелі), Фосфор, який міститься у всіх газованих напоях.
Використання сполук кальцію у медицині та фармації:
- Кальцій хлорид - протиалергічний, протисудомний засіб (тільки в/в !);
- Кальцій сульфат– гіпс;
- Кальцій глюконат – протиалергічний засіб, проявляє седативну дію на ЦНС.
В організмі людини вміст Магнію становить 0,03% (мас.). Депо цього елементу – кістки, м’язи, біологічні рідини, в основному плазма крові.
Сполуки Магнію містяться у внутрішньоклітинних рідинах у вигляді гідратованих йонів, а у кістках скелета та емалі зубів - у вигляді нерозчинних фосфатів. Йони Магнію входять до складу біокомплексів з нуклеїновими кислотами. У складі комплексу з АТФ, Магній активує процеси синтезу і гідролізу цієї біологічно важливої сполуки.
Залежно від концентрації, Магній може як прискорювати, так і гальмувати процес передачі імпульсів по нервових волокнах. Він заспокійливо діє на нервову систему, впливає на обмін Калію і Кальцію.
Магній входить до складу ферментів, позитивно впливає на вуглеводний та фосфорний обміни, сприяє виділенню жовчі, стимулює перистальтику кишківника.
Багато Магнію міститься в листках рослин, куди він у формі йона Мg2+ входить до складу хлорофілу, що за своєю структурою нагадує гем крові.
Добова потреба дорослої людини складає приблизно 300мг.
Найкращі джерела Магнію: соєві боби, горіхи, крупи, м’ясо, риба (особливо морські продукти) і фініки. В продуктах рослинного походження його більше, ніж в продуктах тваринного походження.
Використання сполук магнію у медицині та фармації:
Магній сульфат 25% парентерально:
- гіпотензивна дія;
- протисудомна дія;
- седативна дія;
- зменшує набряк головного мозку;
Магній сульфат 33% внутрішньо:
- проносна дія;
- жовчогінна дія.
Магній оксид:
- антацидна дія.
Барій (Ва) не відносять до біогенних елементів. Найбільший вміст цього елемента виявлено у пігментній оболонці ока. У крові його концентрація становить приблизно 8-9 мкг. Доведено, що малі дози сполук Барію стимулюють діяльність кісткового мозку, але у більших кількостях вони отруйні.
Вміст Барію в крові знижується при ішемічній хворобі серця та при захворюванні органів травлення, що може служити додатковим діагностичним критерієм цих захворювань.
У медичній практиці використовують малорозчинну сіль Барію (ВаSО4, барій сульфат) у рентгенодіагностиці шлунково-кишкового каналу, оскільки вона добре вбирає рентгенівське випромінювання і як малорозчинна речовина виводиться з організму у незмінному виді.
Стронцій (Sr) нагромаджується в кістках, в яких він легко заміщує Кальцій, що входить до складу фосфатів. Є відомості, що Стронцій бере участь в утворенні кісткової тканини, зміцнює емаль зубів. Проте його ізотоп 90Sr- дуже небезпечний для живих організмів радіонуклід. Внаслідок випробувань ядерної зброї або при аваріях на ядерних реакторах, встановлених на електростанціях, підводних човнах, криголамах, цей нуклід нагромаджується в атмосфері. Потрапляючи в організм, він викликає променеву хворобу, лейкоз або злоякісні пухлини кісток.
У медичній практиці використовують Бівалос- препарат для лікування кісток шляхом їх мінералізації.
Радій (Ra) надзвичайно радіотоксичний. В організмі він поводить себе подібно до кальцію — близько 80% радію, що потрапляє в організм, накопичується в кістковій тканині. Великі концентрації радію викликають остеопороз, самовільні переломи і злоякісні пухлини кісток та кровотворної тканини. Небезпеку несе також радон — газоподібний радіоактивний продукт розпаду радію.
Передчасна смерть Марії Кюрі, яка відкрила радій як елемент, сталася внаслідок хронічного отруєння радієм, тому що в той час ще не було усвідомлено небезпеку опромінення.
В медицині радій використовують як джерело радона для приготування радонових ван (хоча в даний час їх користь піддається сумнівам). Окрім цього, нуклід радію у вигляді металічних голок застосовувався раніше в онкології, особливо при лікуванні раку матки. Оскільки він дає дуже жорстке гамма-випромінювання, то опроміненню піддавався практично весь організм хворого. Тому в останній час в медицині практично не використовується.
МАТЕРІАЛИ ЗАКЛЮЧНОГО ЕТАПУ
ПИТАННЯ ДЛЯ ЗАКРІПЛЕННЯ:
- Скільки електронів знаходиться на зовнішньому рівні у атомів елементів головної підгрупи І групи?
- Яка хімічна активність елементів головної підгрупи І групи?
- Де і в якому вигляді міститься Натрій, Літій та Калій у природі?
- Охарактеризуйте фізичні властивості металів головної підгрупи І-А групи.
- Перерахуйте хімічні властивості металів головної підгрупи І-А групи.
- Які Оксигеновмісні сполуки металів головної підгрупи І-А групи вам відомі? Охарактеризуйте їх фізичні та хімічні властивості.
- Які елементи відносяться до головної підгрупи ІІ групи? Які це елементи?
- Скільки електронів знаходиться на зовнішньому рівні у атомів елементів головної підгрупи ІІ групи?
- Які ступені окиснення можуть виявляти елементи ІІ-А підгрупи ?
- Охарактеризуйте фізичні властивості металів головної підгрупи ІІ-А групи.
- Перерахуйте хімічні властивості металів головної підгрупи ІІ-А групи. Напишіть відповідні рівняння хімічних реакцій.
- Які Оксигеновмісні сполуки металів головної підгрупи ІІ-А групи вам відомі? Охарактеризуйте їх фізичні та хімічні властивості.
- Де і в якому вигляді містяться метали ІІ-А групи у природі?
- Які сполуки металів головних підгруп І-А та ІІ-А груп застосовують у медицині та фармації?
Завдання. Здійсніть перетворення :
а) Ва ВаO Ва(NO3)2 ВаСО3 ВаCl2
б) Сa → CaO → Ca(OH)2 → CaCO3 → CaCl2
![]()
![]()
![]()
в) NaOH ← Na → NaCl → NaNO3 → NaNO2
↓
Na2O2
Тести:
- Виберіть рядок, у якому переліченні лужноземельні метали:
а) Li, Na, Ba;
б) Ca, Sr, Ba;
в) K, Fe, Cs;
г) Na, Li, Rb.
- Виберіть електронну родину хімічних елементів, до яких належать лужні метали:
а) s–елементи;
б) p-елементи;
в) d-елементи;
г) f-елементи.
- Виберіть колір, у який забарвлюють полум’я йони Na+:
а) зелений;
б) червоний;
в) жовтий;
г) синій.
- За допомогою яких методів можна отримати магній фосфат?
|
І. Метал + кислота ІІ. Сіль + сіль ІІІ. Метал + основа ІV. Неметал + кислота V. Основа + кислота
|
Варіанти відповідей: А. І, II, ІІІ В. II, IV, V C. I, II, V D. I, II, IV
|


про публікацію авторської розробки
Додати розробку






