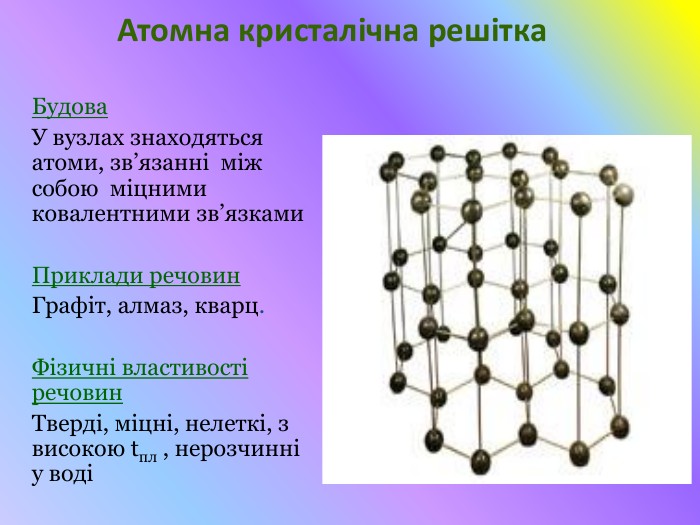
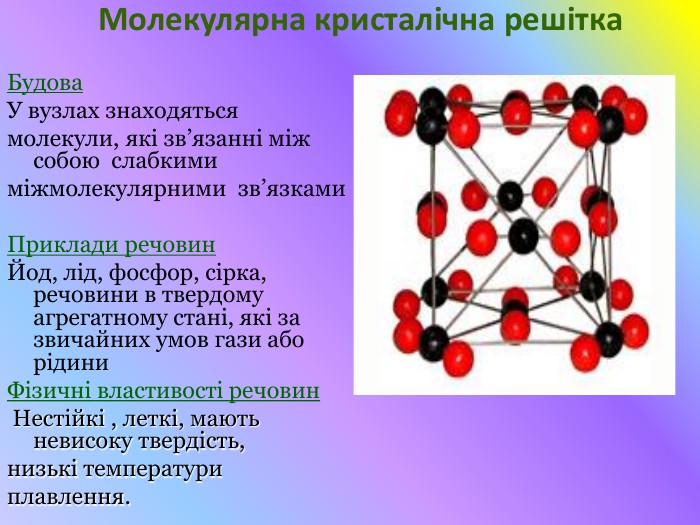
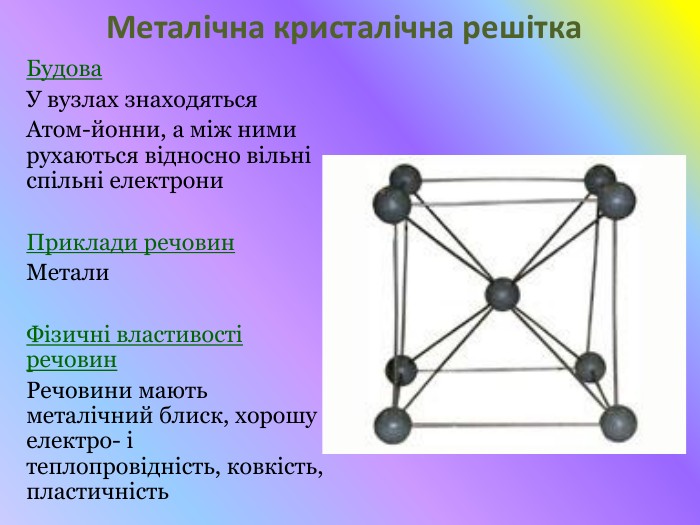
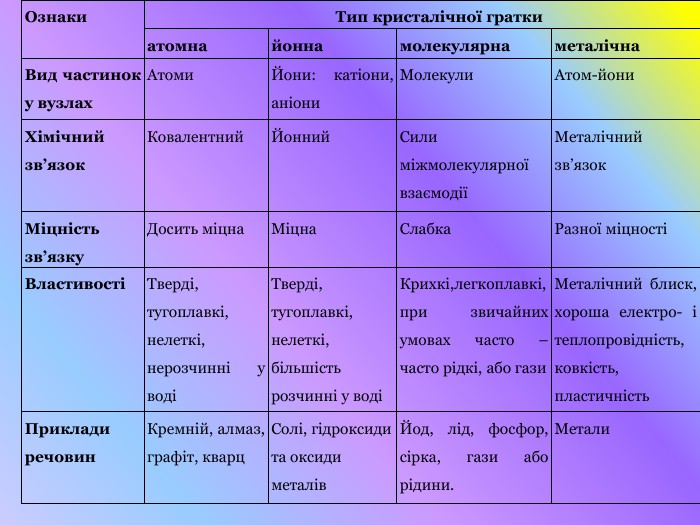
Презентація "Кристалічні решітки"
Про матеріал
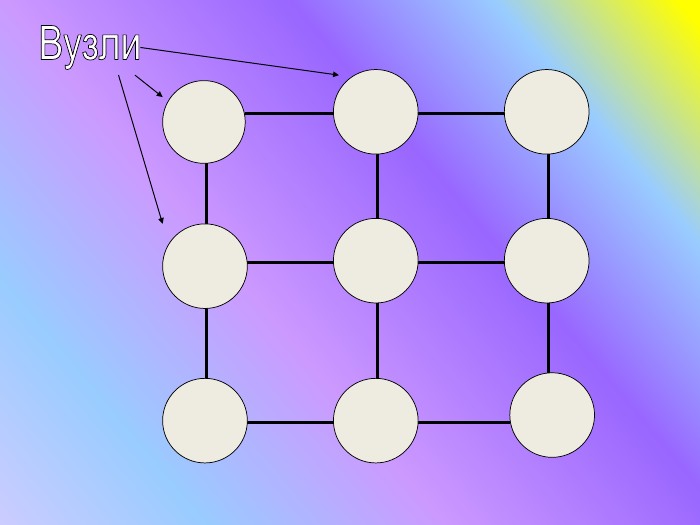
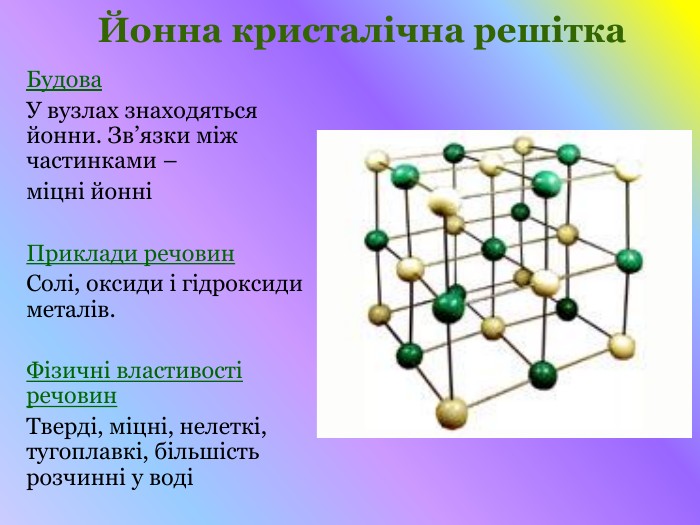
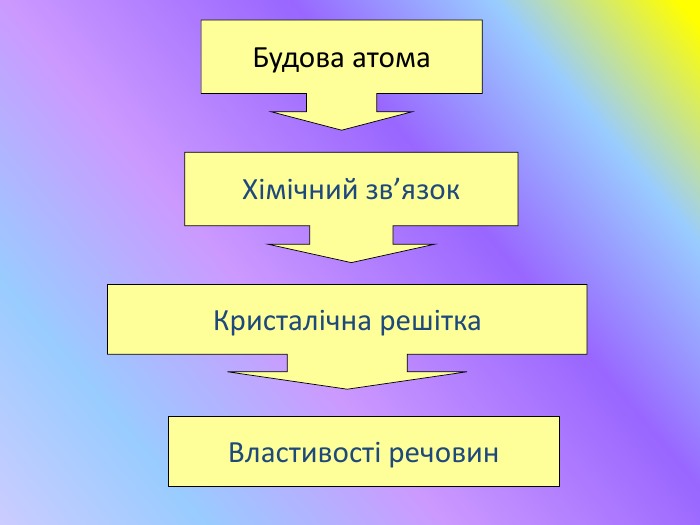
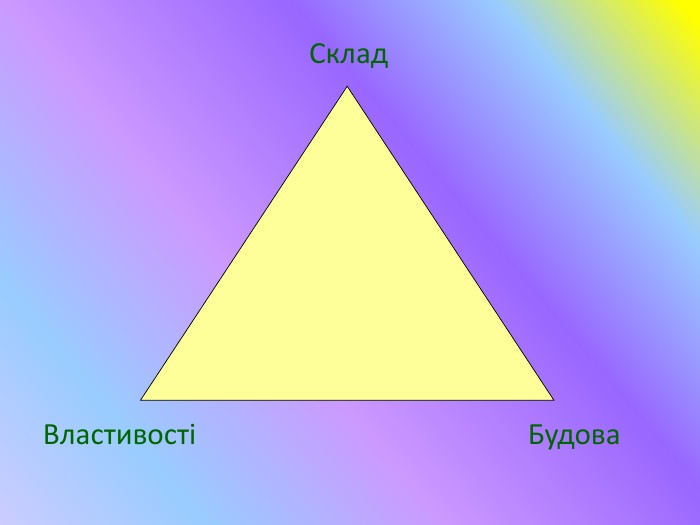
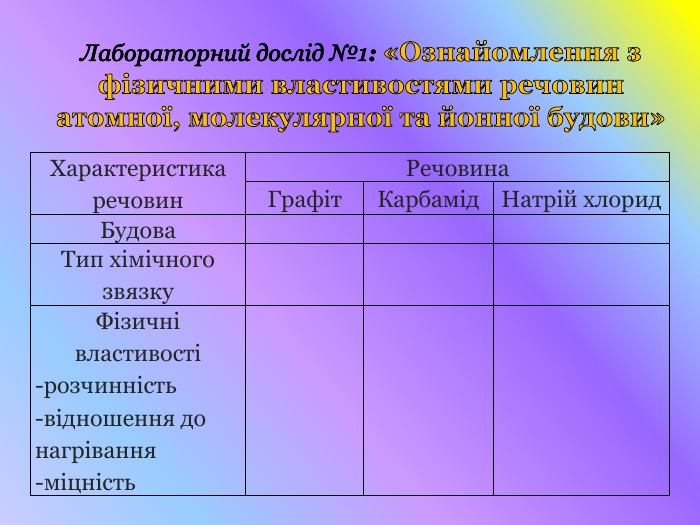
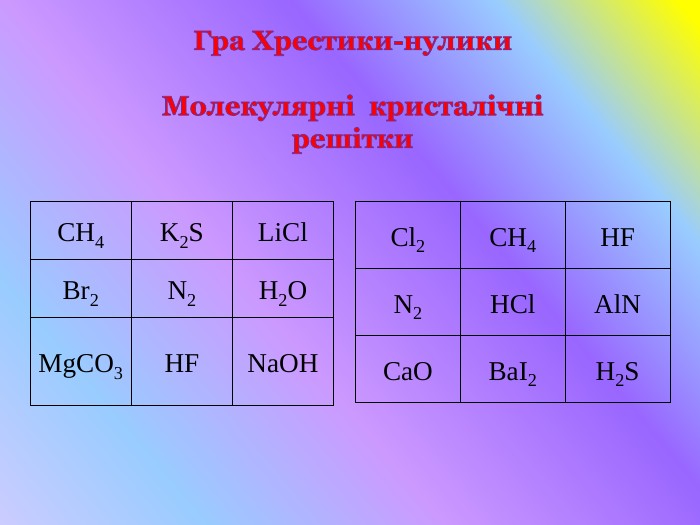
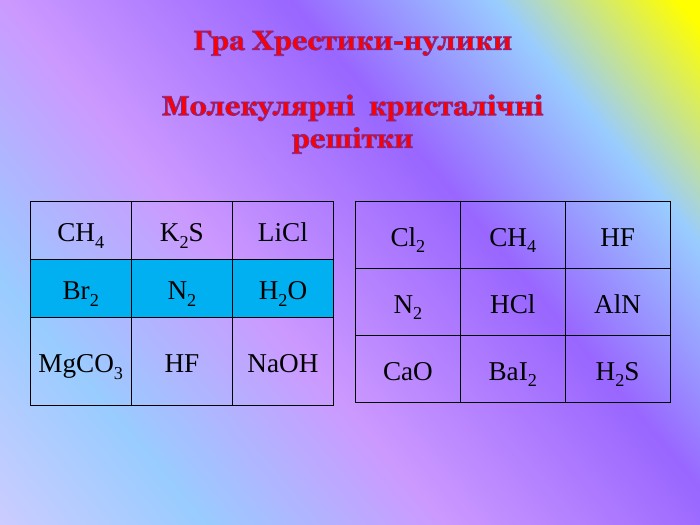
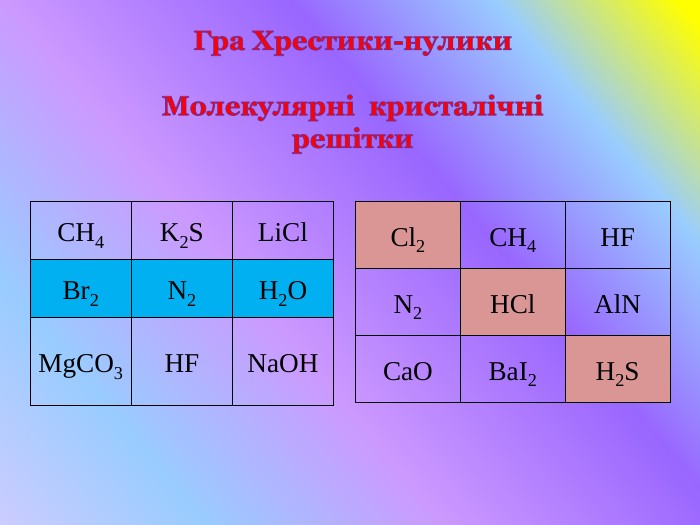
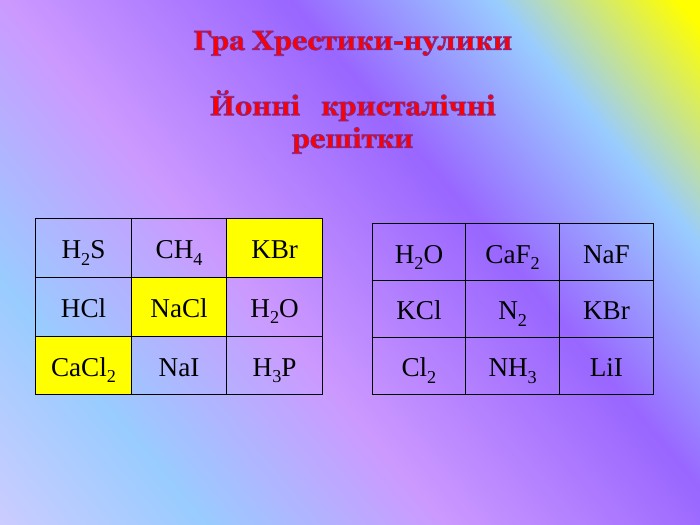
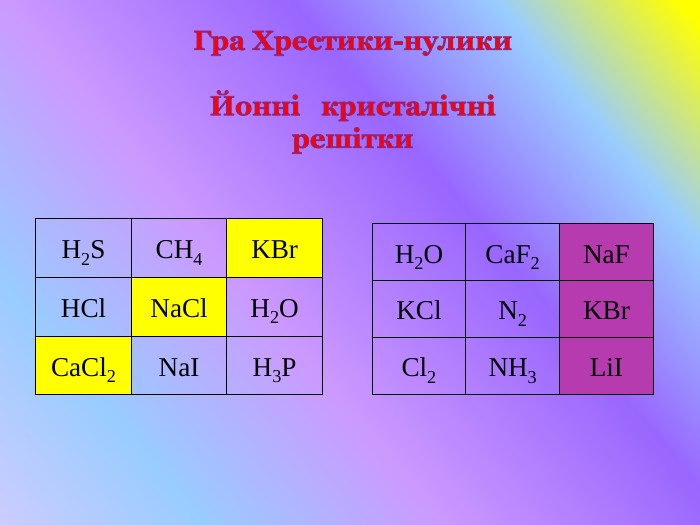
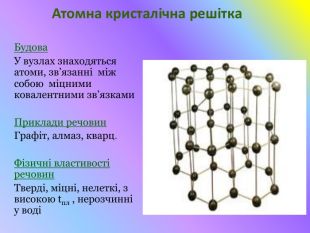
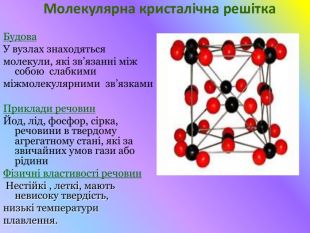
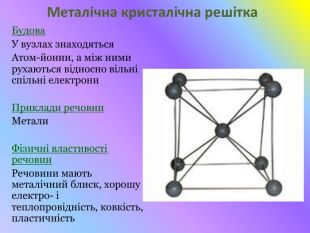
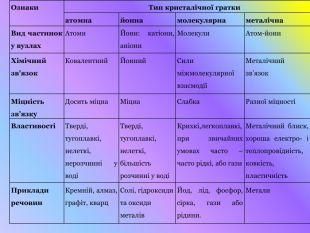
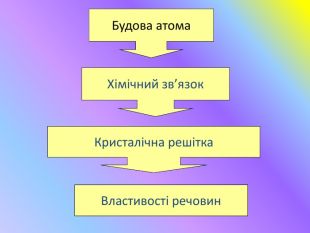
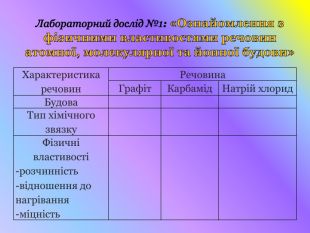
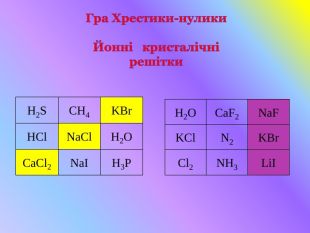
Кристалічні гратки. Атомні, молекулярні та йонні кристали. Залежність фізичних властивостей речовин від типу кристалічних граток
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку