Презентація "Металічні елементи"
Про матеріал
Презентація призначена для 11 класу (підручник П.Попель, Л.Крикля) для закладів загальної середньої освіти з теми "Металічні елементи". Матеріал містить 26 слайдів в яких висвітлені наступні питання:
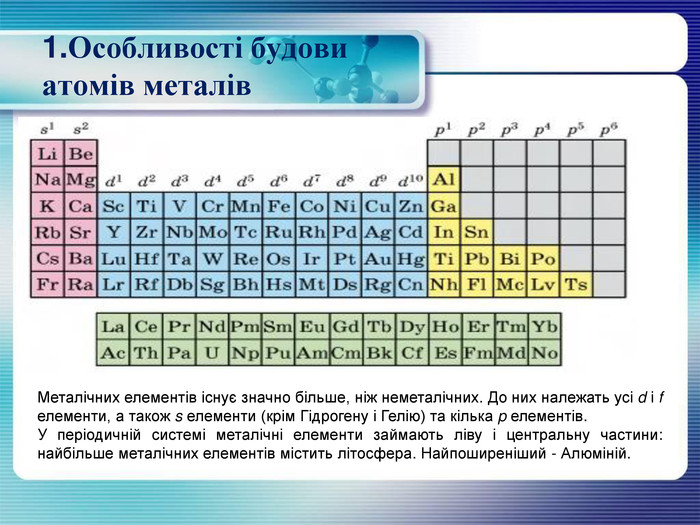
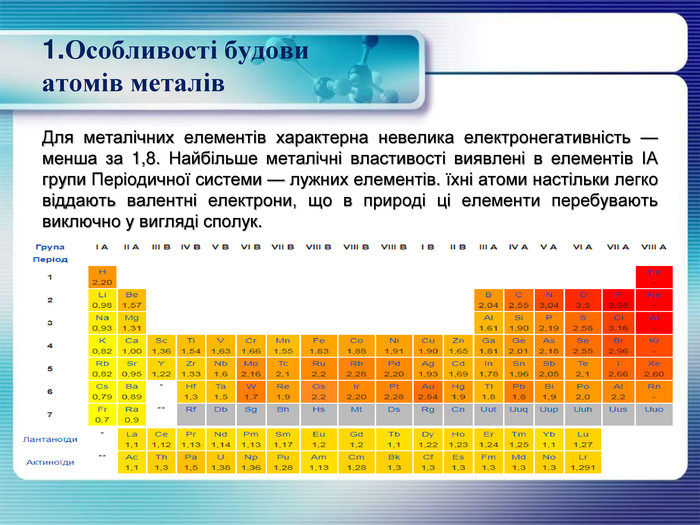
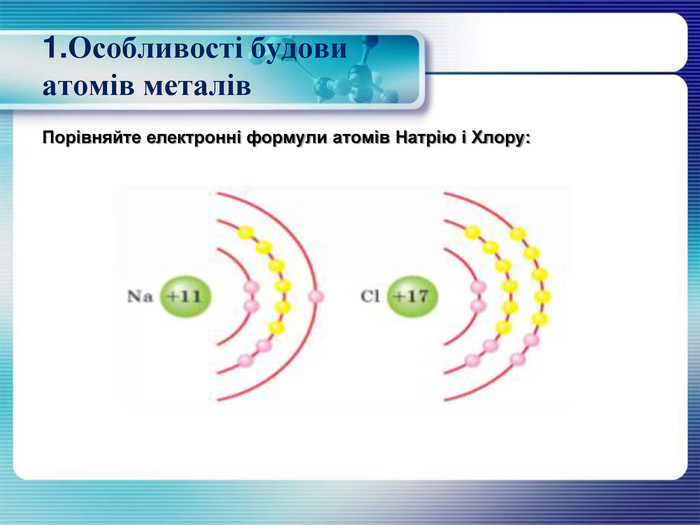
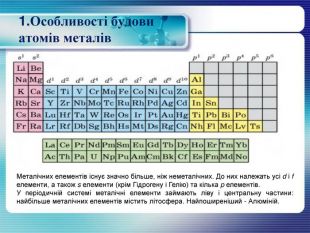
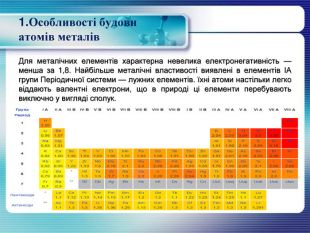
1. Особливості будови атомів металів
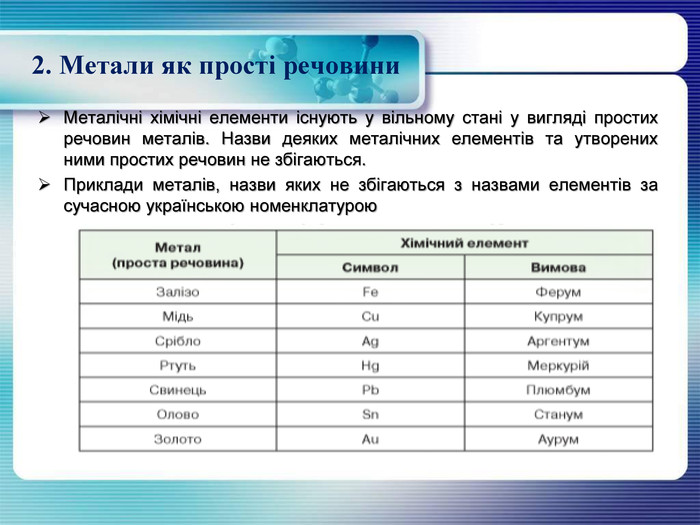
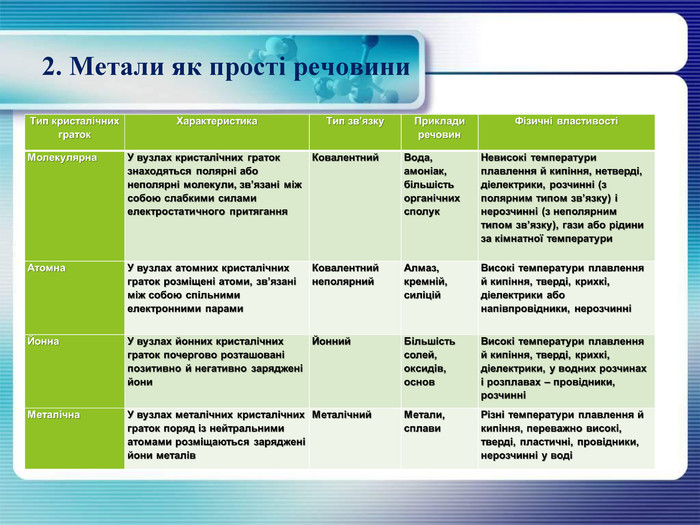
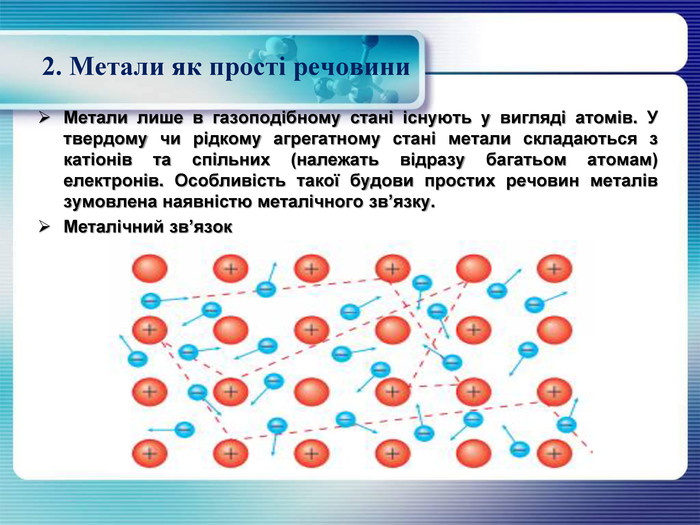
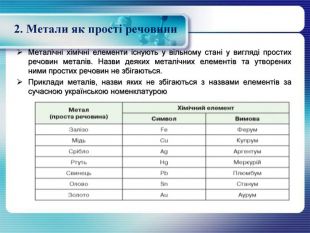
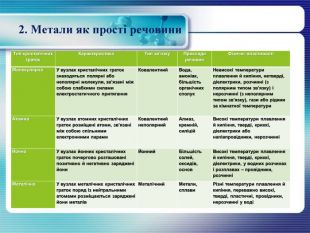
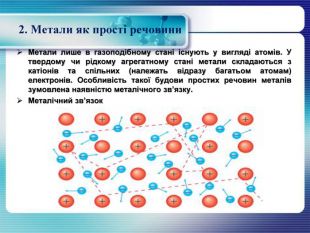
2. Метали як прості речовини
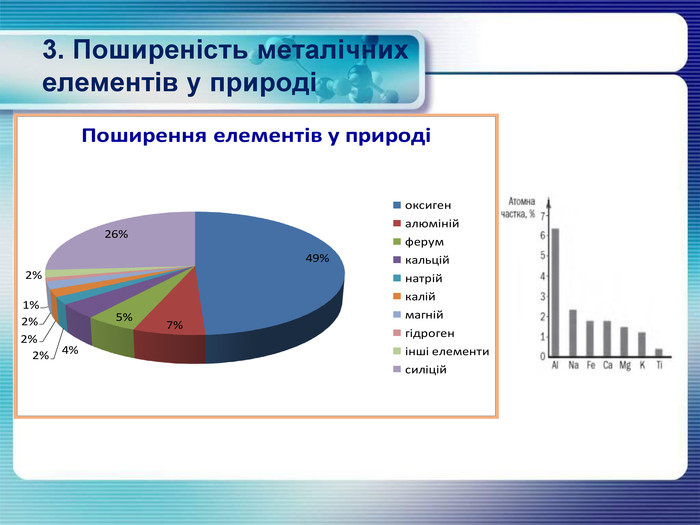
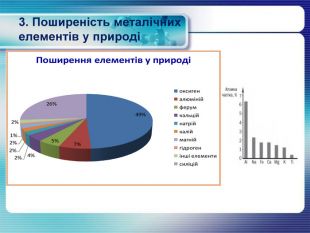
3. Поширеність металічних елементів у природі
4. Фізичні властивості
5. Сплави металів.
6. Хімічні властивості
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
Гарна презентація, матеріал чітко структурований в повністю відповідає плану!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку