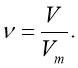Тема уроку :ЗАКОН АВОГАДРО. МОЛЯРНИЙ ОБ’ЄМ ГАЗІВ. 8 клас
Тема уроку :ЗАКОН АВОГАДРО. МОЛЯРНИЙ ОБ’ЄМ ГАЗІВ. 8 клас
Цілі:
- Формування ключових компетентностей:
- саморозвитку й самоосвіти — створення проблемних ситуацій, уміння розв’язувати задачі;
- інформаційної — вміння робити короткий раціональний запис, робити висновки та узагальнення.
- Формування предметних компетентностей: формувати розуміння закону Авогадро, поняття «молярний об’єм газів»; формувати вміння проводити обчислення кількості речовини газів за відомим об’ємом, і навпаки; розвивати хімічну мову; виховувати інтерес до хімії як науки.
Обладнання: роздавальний матеріал, мультимедійний проектор, комп’ютер.
Тип уроку: ВНМ (Д).
Форми роботи: бесіда, взаємоопитування, «Лови помилку», «Вірю — не вірю».
ХІД УРОКУ
І. ОРГАНІЗАЦІЯ КЛАСУ
ІІ. ОГОЛОШЕННЯ ТЕМИ Й МЕТИ УРОКУ
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
(Основні поняття та необхідні схеми проектують на екран.)
Прийом «Взаємоопитування»
Учні працюють у парах, пригадуючи вивчені раніше поняття.
Прийом «Лови помилку»
Завдання проектують на екран.
Обрати правильно записану формулу:
-
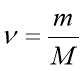 ;
; 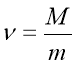 ;
; 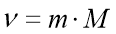 ;
;
-
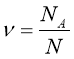 ;
; 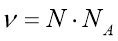 ;
; 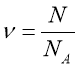 ;
;
-
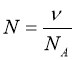 ;
; 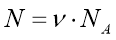 ;
; 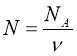 ;
;
-
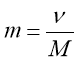 ;
; 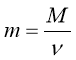 ;
; 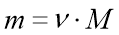 .
.
IV. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
- Як пов’язати кількість речовини й об’єм газу?
- Який об’єм займає 1 моль газу?
V. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Формулювання закону Авогадро.
2. Розповідь про нормальні й стандартні умови:
н. у.: Т = 273 К (0 °С), р = 101,325 кПа;
ст. у.: Т = 298 К (25 °С), р = 101,325 кПа.
3. Речовини, що за звичайних умов є газами, мають молекулярну будову. Відстані між молекулами, порівняно з їхніми розмірами, набагато більші й приблизно однакові для всіх газів за однакових умов. Якщо взяти 6,02⋅1023 молекул будь-якого газу за нормальних умов, то вони займуть однаковий об’єм.
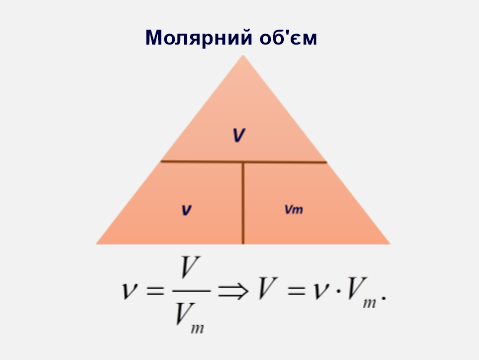
4. Дати поняття «молярний об’єм».
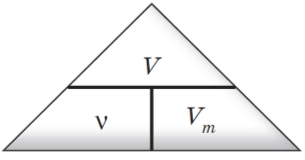

5. Молярний об’єм: Vm = 22,4 л моль.
6. Молярний об’єм можна обчислити за молярною масою газу й густиною:
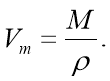
Задача
Обчислити кількість речовини кисню об’ємом 1,12 л.
Аналіз задачі: Що відомо? Що знайти? Як це зробити?
|
Дано: V (O2) = 1,12 л |
Розв’язання 1. Яка кількість речовини кисню?
|
|
ν (O2) = ? |
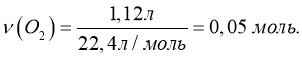
Відповідь: ν (O2) = 0,05 моль.
VІ. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
1 Розв’язування задач
Учням пропонують роздавальний матеріал із переліком задач.
Одну задачу учень розв’язує біля дошки.
1. Обчислити об’єм карбон(ІІ) оксиду (н. у.) кількістю речовини 0,1 моль.
2. Обчислити кількість речовини вуглекислого газу об’ємом 6,72 л за н. у.
3. Обчислити кількість молекул, що містяться у хлорі об’ємом 4,48 л за н. у.
2 Прийом «Вірю — не вірю»
(Запитання проектують на екран.)
1. Температура за нормальних умов дорівнює 20 °С.
2. Молярний об’єм газів за нормальних умов дорівнює 22,4 л/моль.
3. Знаючи кількість речовини газу, можна обчислити його об’єм.
4. 1 моль будь-якого газу має масу 20 г.
5. Об’єм азоту кількістю речовини 2 моль дорівнює 11,2 л.
VІІ. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
VІІІ. ДОМАШНЄ ЗАВДАННЯ












про публікацію авторської розробки
Додати розробку