Презентація "Методи одержання вуглеводнів. Взаємозв'язок між вуглеводнями"
Про матеріал
Презентація до уроку хімії у 10 класі "Методи одержання вуглеводнів. Взаємозв'язок між вуглеводнями". Перегляд файлу
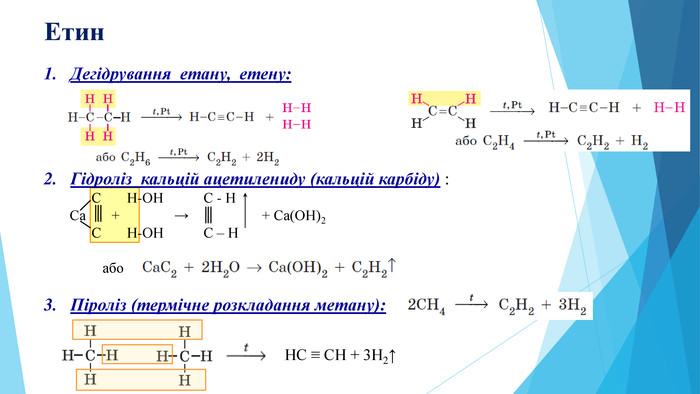
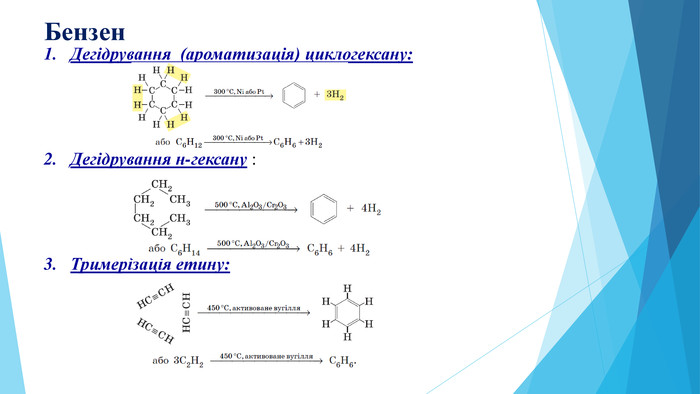
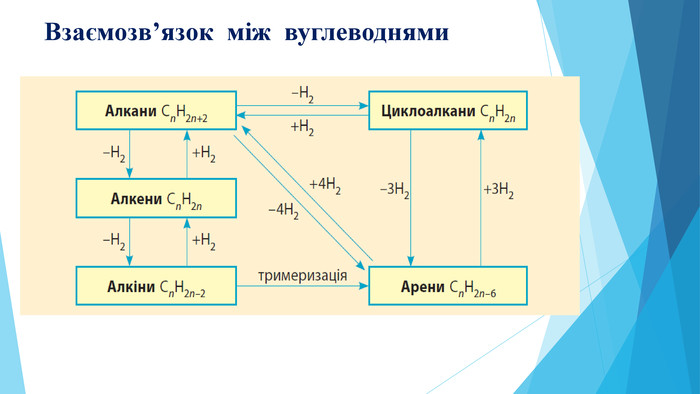
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку